qPCR技术
- 首先了解PCR
- qPCR怎么个q法
- 实时荧光定量PCR
- 基本概念
- 扩增曲线
- 标准曲线
- 基线期
- 指数增长期
- 平台期
- 阈值
- Ct值
- qPCR原理
- 荧光染料技术:
- *水解探针技术
- 荧光共振能量转移技术
- 分子信标技术
- 荧光定量PCR
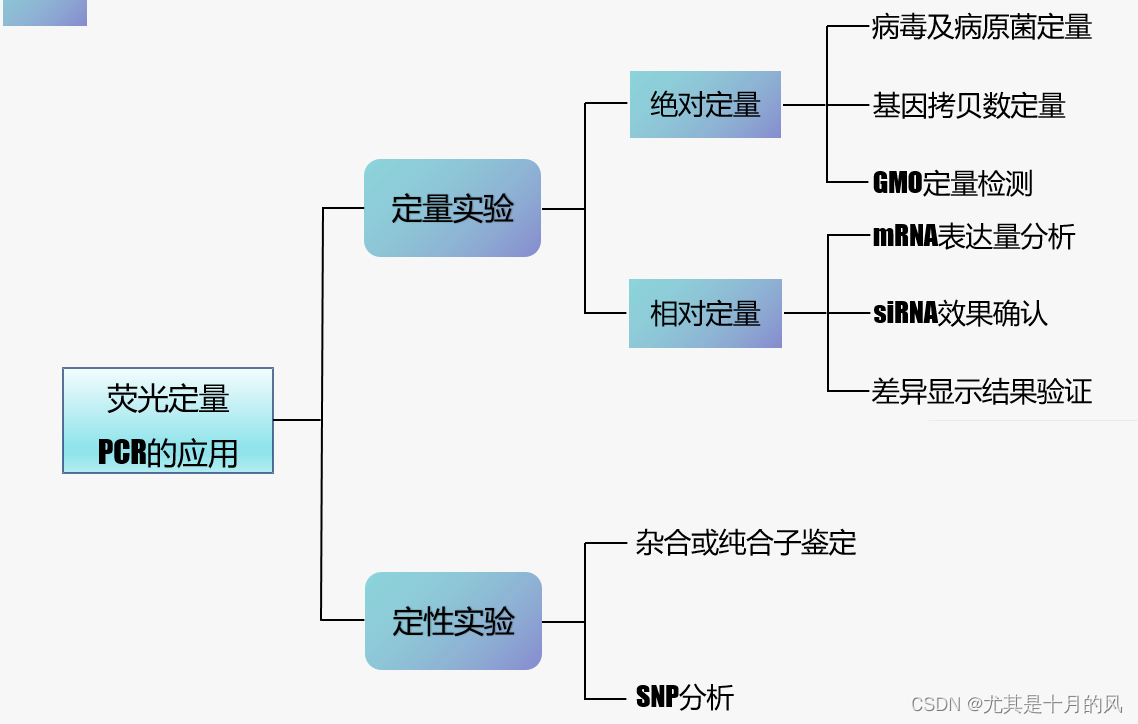
- 绝对定量与相对定量概述
- 定量分析常见术语
- 什么是绝对定量?
- 什么是相对定量?
首先了解PCR
PCR
qPCR怎么个q法
qPCR和PCR一看名字就知道很像,其中 q 就是 quantitative 的意思,quantitative就是定量的意思。
qPCR == 实时荧光定量PCR(Quantitative Real-time PCR)
qPCR就是在PCR反应中加入荧光基团,检测每次PCR循环后产物总量的方法。然后进行定量分析。
实时荧光定量PCR
实时:每一次PCR循环结束都可以检测并记录荧光信息
荧光:分为荧光染料和荧光探针
定量:通过荧光强度和Ct值信息,根据标准曲线获得定量结果
PCR:DNA扩增
基本概念
扩增曲线
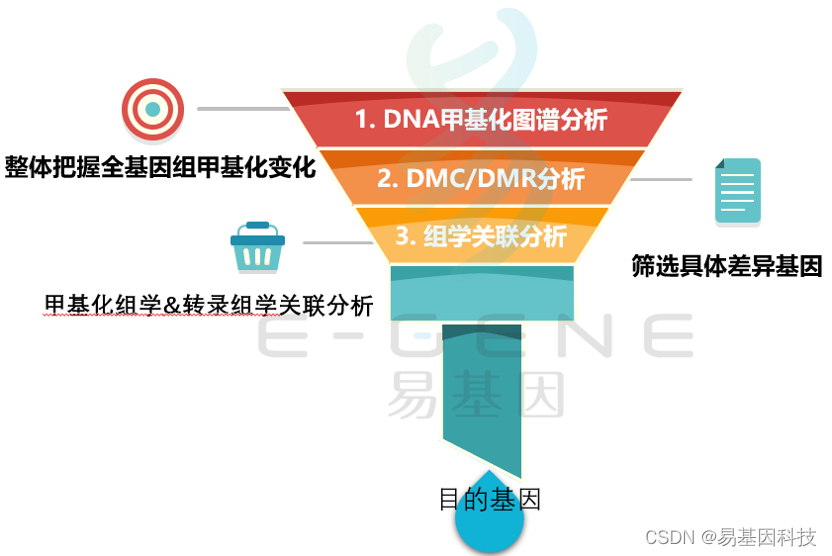
在qPCR中,对整个PCR反应扩增过程进行了实时的检测并记录其荧光信号,随着反应的进行,监测到的荧光信号可以绘制成一条曲线,即为扩增曲线。
横轴为Cycle,代表循环次数。纵轴为Rn,是报告基团染料(FAM)的荧光除以惰性参比染料(ROX)的荧光的比值。
标准曲线
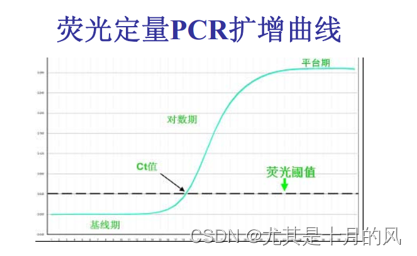
纵轴为Ct值,横轴为浓度(稀释倍数)
两个样品(X 和 Y)分别在低效率和高效率条件下扩增,在靶浓度相同的条件下得到了不同的 Ct 值。在此图中,尽管高效率条件(图中的蓝色曲线)在高浓度时产生的 Ct 值更晚,但它在靶浓度低时却更为灵敏。
PCR 效率取决于实验、预混液性能和样品质量。通常情况下,反应效率在 90-110% 之间都是可以接受的。
基线期
基线期:在Real-time qPCR扩增早期,扩增的荧光信号被荧光背景信号所掩盖,无法判断产物量的变化,此时即为基线期。
指数增长期
对数期(指数增长期):PCR反应过程中产生的DNA拷贝数是呈指数形式增加的
平台期
平台期:随着反应循环数的增加,最终PCR反应不再以指数形式生成模板,从而进入“平台期”
在平台期,扩增产物已不再呈指数级的增加,PCR的终产物量与起始模板量之间无线性关系,所以根据最终的PCR产物量不能计算出初始模板量。
只有在荧光信号的对数期(指数增长期),PCR产物量的对数值与起始模板量之间存在线性关系,可以选择在这个阶段进行定量分析。
阈值
荧光阈值:PCR扩增信号进入相对稳定扩增对数期时的荧光值。荧光阈值是在扩增曲线上人为设定的一个值,它可以设定在指数扩增阶段任意位置上,阈值应设置为高于基线,但应该足够的低,使其控制在扩增曲线的对数期。(为了使得扩展率更加接近2倍)
通常荧光阈值都是Real-time qPCR仪器自动设置,如无特殊情况,无需更改。
Ct值
Ct值(循环阈值 Cycle threshold value) :即Real-time qPCR扩增过程中扩增产物的荧光信号达到设定的荧光阈值时所经过的扩增循环次数,Ct值与荧光阈值有关。荧光阈值和扩增曲线的交点。
阈值循环(threshold cycle, Ct),交点(crossing point, Cp),分支点(take-off point, TOP),定量循环(quantification cycle, Cq) 这些术语指的实际上在实时仪器是相同的值,只是不同仪器厂家为了竞争给自己产品的特定定义,不具有准确性和清晰性。
一般Ct值位于指数增长期的开始阶段,此时样品间细小物差尚未放大且扩增效率也相对恒定,因此该Ct值具有极好的重复性,尽管平台期的DNA拷贝数波动很大,Ct值却是相对固定的。
qPCR原理
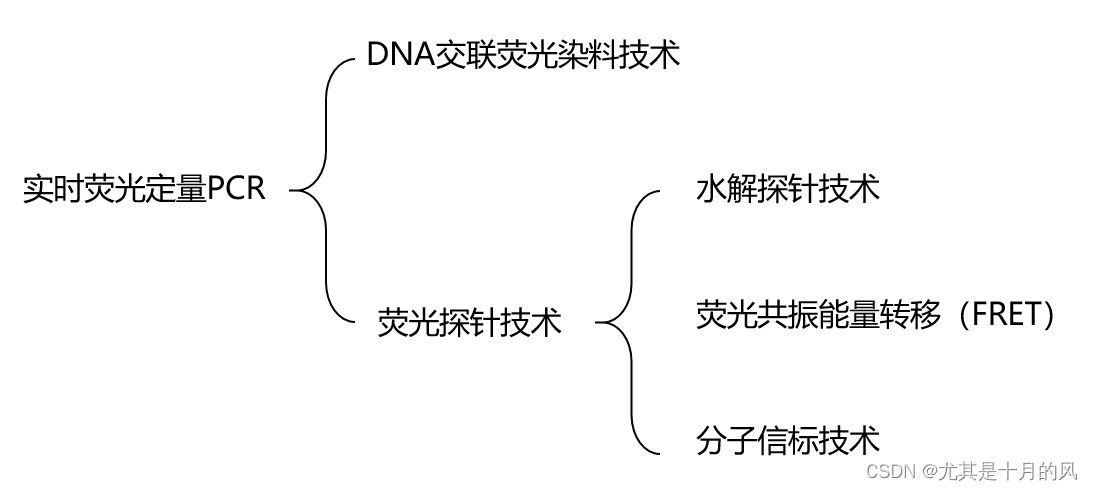
荧光染料技术:
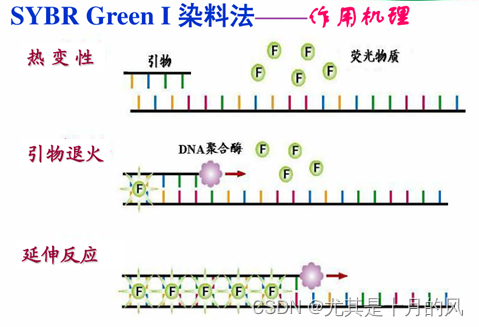
SYBR荧光染料 (SYBR Green I染料试剂)
在退火和延伸过程中,荧光染料分子结合到DNA分子中,结合前荧光信号微弱,结合后荧光信息急剧增加。根据荧光信号检测出双链DNA数量。
*水解探针技术
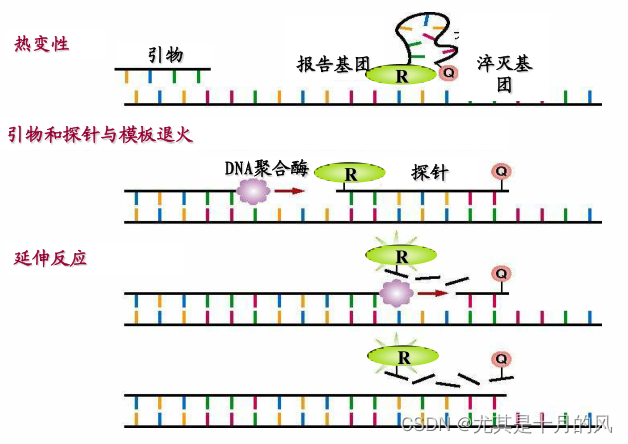
**TaqMan probe技术 **== 水解探针(hydrolysis probes)
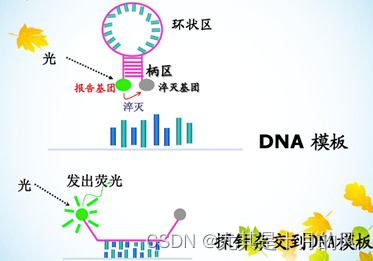
在退火过程中,加入引物的同时也加入荧光探针(具有特异性),PCR扩增时,探针的报告基团(发荧光)和淬灭基团(抑制荧光)分离,从而荧光信号被检测到。即每扩增一条DNA链,就有一个荧光分子形成。同步。
荧光共振能量转移技术
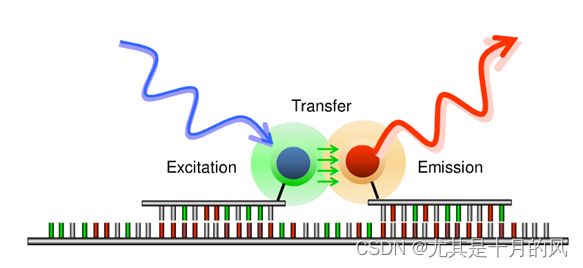
FRET probe (fluorescence resonance energy transfer probe, 荧光共振能量转移探针)
扩增过程中,探针与模板杂交时两种染料互相接近,两探针能进行荧光共振能量转移,转移过程中,外来光源首先刺激供体荧光染料,供体便发光刺激附近受体荧光染料,使后者在发射出另一种波长的信号而被系统检测接受。由于受体荧光染料只有在两个探针都与模板杂交时才会被激发而发射荧光信号,所以对信号的检测是在退火后进行。
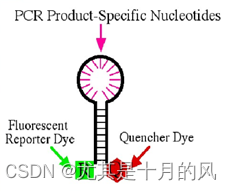
分子信标技术
分子探针由非特异的颈和特异的环组成,探针的5’端标记荧光分子,3’端标记一个吸收或淬灭荧光分子。自身环化时仪器检测不到荧光,在PCR反应退火阶段,探针因与模板链杂交而打开,使5’端荧光分子与3’端吸收或淬灭基团分子分开,从而被检测到。每一个循环,PCR产物增加,荧光信号增强,从而根据信号来计算产物的增加量。
荧光定量PCR
绝对定量与相对定量概述
当对定量检测的结果进行计算时,可以采用绝对或相对定量。
定量分析常见术语
**扩增子:**PCR过程而产生的DNA短片段
**内参基因:**内参基因指的是参照基因(reference genes)
什么是绝对定量?
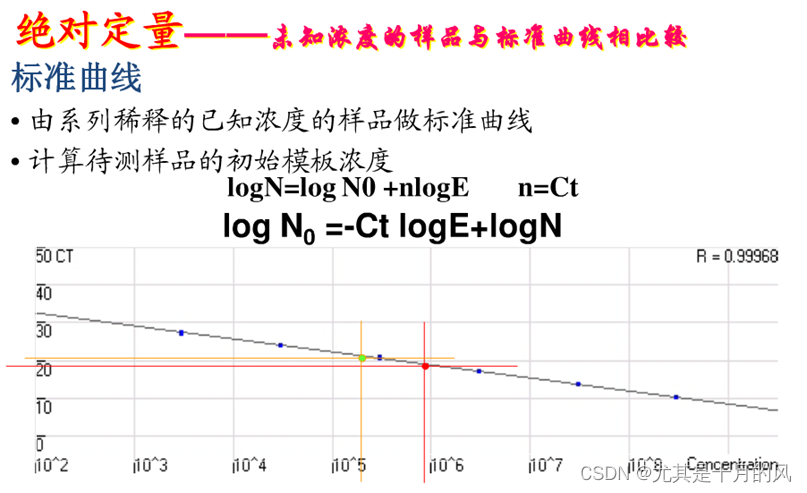
绝对定量是指将未知样品与标准品所制得的标准曲线相比较,从而得出未知样品的绝对初始模板数量。一般标准品就是一个已知绝对浓度的DNA样品。
数据分析:
Q u a n t i t y = Y ⋅ ( 1 + E ) − C t Quantity = Y · (1+E)^{-Ct} Quantity=Y⋅(1+E)−Ct
什么是相对定量?
相对定量用于分析特定样品相对于参照样品(比如,未处理的对照组)某个基因表达量的变化。
相对定量是指两个或更多的基因互相进行比较,其结果是一个比率,没有确切的数字被检测到,这种检测基因表达相对定量的方法叫“比较Ct值法(ΔΔCt)”。该方法可以彻底不需要标准曲线,通过观察样品中目的基因与内参基因的相对变化,从而分析不同样品间目的基因初始模板数的相对变化量。
数据分析:
f o l d = ( 1 + E 1 ) − Δ C t 1 ⋅ ( 1 + E 2 ) − Δ C t 2 fold = (1+E_1)^{-ΔCt_1}·(1+E_2)^{-ΔCt_2} fold=(1+E1)−ΔCt1⋅(1+E2)−ΔCt2
假定两个扩增子效率都为100%,则公式变为
f o l d = 2 − Δ Δ C t fold = 2^{-ΔΔCt} fold=2−ΔΔCt