点击蓝字 关注我们
周丛生物非生物成分的地理印记和生态功能

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.60
● 2022年10月25日,中国科学院南京土壤研究所吴永红团队在iMeta在线发表了题为“Geographic imprint and ecological functions of the abiotic component of periphytic biofilms”的文章。
● 胞外聚合物 (EPS) 是稻田周丛生物的一个重要的非生物成分,蛋白质、多糖和eDNA是其主要成分。本研究表明,周丛生物的EPS具有明显的地理印记,其EPS含量随着纬度的增加而减少,而EPS的蛋白质和多糖成分的比例显示出相反的趋势。温度和光照是驱动周丛生物中EPS的地理分布的主要因素。
● 第一作者:孙朋飞
● 通讯作者:吴永红 (yhwu@issas.ac.cn)
● 合作作者:刘颖瑶、孙瑞、Jan Dolfing
● 主要单位:中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室、中华人民共和国水利部秭归三峡水库生态系统观测研究站、南京信息工程大学长望学院、英国Northumbria大学工程与环境学院
亮 点

● 定量了稻田周丛生物非生物成分 (胞外聚合物, EPSs)
● 进一步研究了微生物群落对EPS的影响,以及EPS的地理分布规律和生态功能
全文解读
引 言
在自然界中,大多数微生物以聚集体、絮凝体或生物膜的形式生长,由自产的胞外聚合物(EPS)连接在一起。周丛生物生物膜就是一个典型的例子。这些聚集体由自养生物和异养生物组成,生长在自然水生生态系统(例如溪流、湿地、河流等)和人工湿地(例如稻田)中,它们在调节元素循环中发挥着多重关键作用。由于人们对稻田过量施肥的担忧,基于周丛生物的氮(N)和磷(P)管理越来越受到重视。例如,周丛生物对磷的积累有利于减少其从稻田向邻近生态系统的迁移。
周丛生物的微生物成分研究相对深入,而对非生物成分的关注较少。目前对周丛生物中EPS含量和组成以及该基质的潜在生态功能知之甚少。众所周知,EPS是天然水生生态系统中生长的生物膜的重要组成部分,并且生物膜的EPS 组成对栖息地的一些因素很敏感,例如光照、温度和养分有效性。这导致了一种假设,即在水田中生长的生物膜(即周丛生物)和在自然水生生态系统中生长的生物膜相比,EPS的含量和组成均有很大差异。一般来说,EPS的两个主要成分是蛋白质和多糖,占EPS总质量的70%-80%以上,另外还有少量的其他化合物,如eDNA然而,目前对稻田中生长的周丛生物中EPS的蛋白质、多糖和eDNA的主要成分研究较少。
地理分布格局是宏观生态学和生物地理学的中心主题之一。作为周丛生物的栖息地,中国的稻田分布在六个地理区域。栖息地自然地理的差异导致了周丛生物微生物组成的区域差异。鉴于微生物是影响周丛生物中EPS成分和含量的主要因素,这就引出了第二个假设,即生长在不同地理区域稻田的周丛生物的EPS特征会表现出不同的地理分布模式。然而,到目前为止,EPS组分在周丛生物中的地理分布规律尚不清楚。此外,EPS成分是否以及如何受到自然地理特征(如温度、光照和降水)的影响仍有待研究。
EPS的重要性由其生态功能决定。众所周知,EPS 可作为生活在生物膜中的微生物的骨架和保护屏障。近年来,我们对稻田周丛生物的作用进行了一系列研究,发现周丛生物改变了稻田中元素的行为,不同的周丛生物在调控元素循环方面具有不同的潜力。假设在不同地理区域生长的周丛生物之间的EPS含量和成分确实存在差异,那么指导我们工作的第三个假设是EPS的这种变化与不同周丛生物中养分积累的差异有关。
为了验证上述假设,我们在全中国范围内收集了共600份稻田周丛生物、土壤和田面水样本,以解决以下问题:(1) 稻田周丛生物中EPS的含量、主要成分和潜在功能是什么? (2) 周丛生物中EPS是否随着生境的不同而存在地理差异?如果存在,驱动EPS地理分布的主要因素是什么?
结 果
中国稻田周丛生物EPS的数量、主要成分及地理分布
通过对200个周丛生物(图1A)中EPS成分的定量分析,发现中国稻田生长的周丛生物EPS含量(干重)在11.3 ~ 64.9 g/kg之间 (图1A),平均为19.1 g/kg。正如预期的那样,蛋白质和多糖是EPS的两个主要成分。蛋白质水平((9.9-48.9 g/kg,图1B))显著高于多糖水平(1.2-15.9 g/kg,p < 0.001,图1B);蛋白质与多糖的比值在1.8到20之间变化(平均值为5.4,图1A)。EPS中eDNA的含量相对较少,在0.1 ~ 0.7 g/kg之间等(图1B)。这些结果表明,蛋白质成分在EPS中占主导地位。
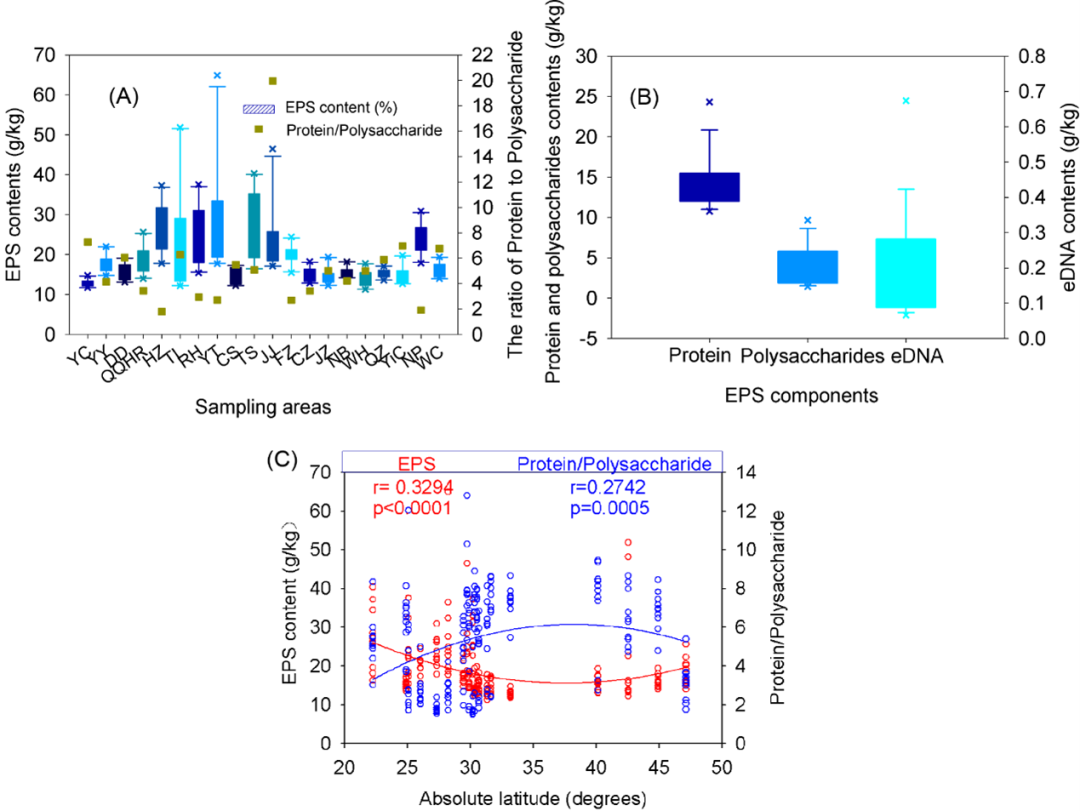
图1. (A)周丛生物中的EPS含量(g / kg)和EPS中蛋白质与多糖的比率;(B)EPS中蛋白质、多糖、eDNA这三种主要成分的含量(g/kg);(C)周丛生物中的EPS含量在纬度梯度上呈现出对比模式,而蛋白质与多糖的比例(蛋白质/多糖)在纬度梯度上呈现出相同的模式。二阶多项式拟合以蓝色(蛋白质/多糖)和红色(EPS 含量)显示。周丛生物采集自20个采样区CS,常熟;CZ, 池州; DD,丹东;FZ, 福州; HZ,杭州;JJ, 九江; JZ, 荆州;NB,宁波;NP,南平;QQHR,齐齐哈尔;QZ, 泉州; RH, 仁华; TL, 铁岭; TS, 泰山; WC, 五常; WH, 芜湖; YC, 盐城; YiC, 宜昌; YT, 鹰潭; YY,岳阳。
在中国稻田中生长的周丛生物中EPS具有明显的地理分布格局:随着生境纬度的增加,周丛生物中EPS含量显著降低(r = 0.3294, p < 0.0001,图1C中红线)。此外,EPS中蛋白质和多糖两种主要成分的比例也呈现出显著但相反的地理分布格局:随着生境纬度的增加,周丛生物中蛋白质与多糖的比例显著增加(r = 0.2742, p = 0.0005,图1C中蓝色线)。结果表明,周丛生物生长纬度越高,其EPS含量越低,蛋白质与多糖的比值越高。从而验证了生长在不同地理区域的稻田周从生物膜中EPS可能呈现地理分布模式的假设。
周丛生物中微生物群落与EPS之间的相互作用网络
在目前的周丛生物样品中,共鉴定出130个原核生物属和145个真核生物属。稻田周丛生物中的真核生物主要由微型真核生物(如绿藻等)及小型动物(如线虫等)组成(图 2A)。具体来说,在属水平,Heteromita、Desmodesmus、Aporcelaimellus、Paratripyla、Characiopodium、Chlorotetraedron、Tubificoides、Chaetomium、Rhabdolaimus 和 Pythium 是周丛生物中丰度最高的前10个真核生物(图2A);黄杆菌属(Flavobacterium)、不动杆菌属(Acinetobacter)、Cyanobium_PCC-6307、Dinghuibacter、Massilia、UTCFX1、拟杆菌属(Bacteroides)、Luteolibacter、Clostridium_sensu_stricto_13和Proteiniclasticum是丰度最高的前10个原核生物(图2B)。因此,可以得出结论,稻田周丛生物中的微生物群落主要由原核生物、微型真核生物和小型底栖生物组成。
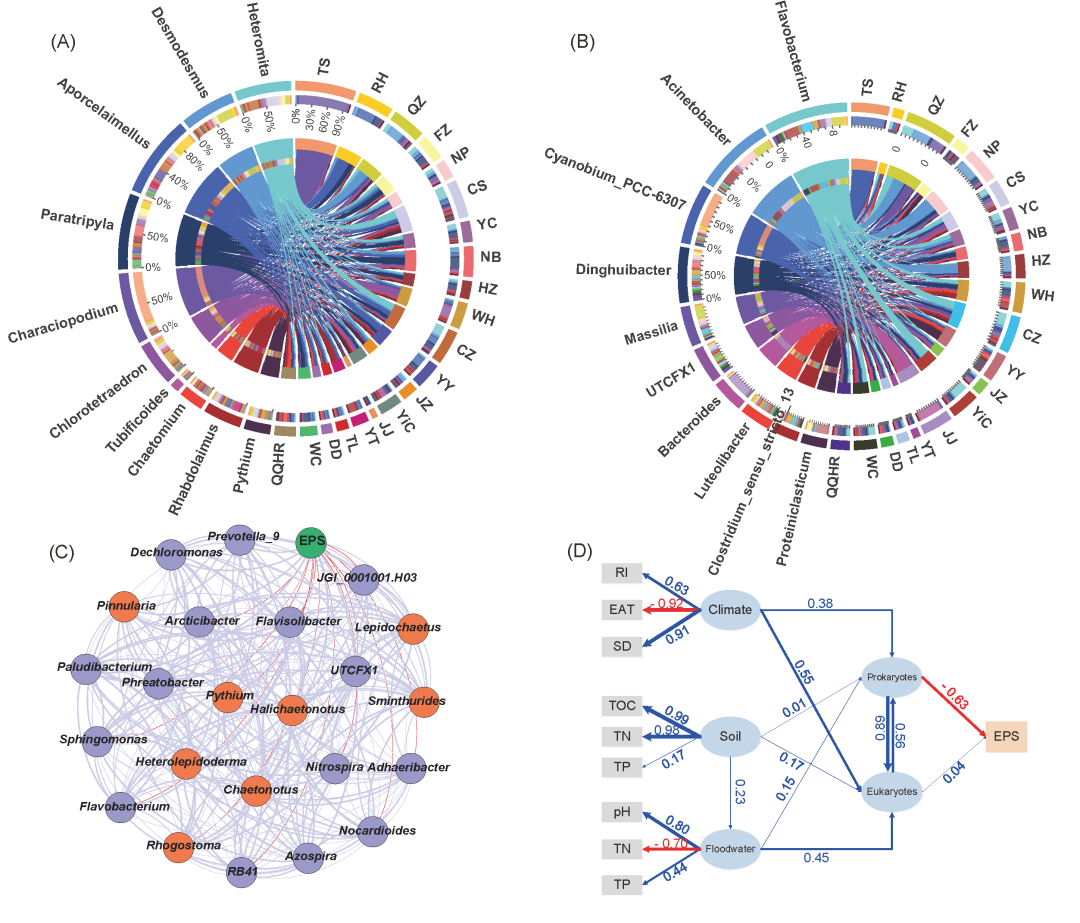
图 2.(A)周丛生物中属水平前10的真核生物;(B)周丛生物中属水平前10的原核生物;(C)原核生物、真核生物和胞外聚合物(EPS)在周围生物膜中的积累之间的相互作用网络;(D)水稻土(总有机碳 [TOC]、总氮 [TN] 和总磷 [TP])、天面水(pH、TN 和 TP)和气候(日照时间 [SD]、辐射强度 [RI] 和有效积温 [EAT]) 对附生生物膜中微生物的影响,以及它们对附生生物膜中 EPS 地理分布模式的影响,如偏最小二乘路径模型 (D) 通过偏最小二乘路径模型分析水稻土(总有机碳 [TOC]、总氮 [TN] 和总磷 [TP])、田面水(pH、TN 和 TP)和气候(日照时间 [SD]、辐射强度 [RI] 和有效积温 [EAT]) 对周丛生物中微生物及EPS地理分布格局的影响。
根据原核生物、真核生物和周丛生物中EPS含量的共线性模式结果,发现共有15个原核生物属和8个真核生物属与周丛生物中EPS的积累显著相关。原核生物中4个属(Prevotella_9、Dechloromonas、Paludibacterium、Azospira)与EPS积累呈显著正相关,而11个属(Sphingomonas, Flavobacterium, RB41, Nocardioides, Adhaeribacter, JGI_0001001.H03, Phreatobacter, Arcticibacter, Flavisolibacter, UTCFX1和 Nitrospira)呈显著负相关(图2C)。值得注意的是,在原核生物的网络中,负相关多于正相关。这表明原核生物对周丛生物中EPS含量的负面影响可能大于正面影响,进而可能使原核生物对周丛生物中EPS含量产生负面影响。相反,在真核生物的网络中,正相关性更多。真核生物中有6个属(Pinnularia、Heterolepidoderma、Lepidochaetus、Sminthurides、Halichaetonotus和Chaetonotus)与周丛生物中EPS的积累呈显著正相关,只有Rhogostoma和Pythium两个属呈现显著负相关(图2C)。这表明真核生物对EPS在周围生物膜中积累的总影响可能是正面的。
影响因素驱动周丛生物EPS的地理分布
原核生物和真核生物都对栖息地生物膜中EPS的地理分布表现出直接影响(图2D)。正如PLS-PM所分析的那样,栖息地生物膜中的原核生物对EPS的地理分布表现出负效应(路径系数=-0.63,图2D),而真核生物发挥了正效应(路径系数=0.46,图2D)。具体来说,真核生物的影响包括对原核生物的弱直接影响(路径系数=0.09,Table S1)加上强间接影响(路径系数=0.37,Table S1)。这些结果表明,原核生物对EPS的地理分布有负面影响,而真核生物主要通过间接影响原核生物而表现出正面作用。
气候因素、土壤和田面水特征是间接因素,影响着微生物成分,推动着周丛生物中EPS的地理分布(图2D)。经PLS-PM分析,气候因素对真核生物和原核生物的总影响分别为0.55和0.69;稻田土壤对真核生物和原核生物的总影响分别为0.28和0.20,田面水对真核生物和原核生物的总影响分别为0.45和0.40(图2D)。综合各因素对微生物组成的影响和微生物组成对EPS含量的影响,气候因素、土壤和田面水对EPS地理分布的总影响分别为-0.41、-0.11和-0.23(Table S1)。
相比之下,这三个外部因素对EPS的总贡献大小顺序为:气候因素>田面水>稻田土壤。因此,我们可以得出结论,气候因素可能是驱动大型稻田中生长的周丛生物中EPS地理分布的主要力量。在分析的气候因素中,日照时间(路径系数=0.91)和辐射强度(路径系数=0.63)都对周丛生物中EPS的地理分布表现出积极影响(图2D)。此外,有效积温显示出明显的负效应(路径系数=-0.92,图2D)。这些模式表明气候因素,特别是温度和光照在决定周丛生物中EPS的地理分布方面的重要作用。
EPS塑造了周丛生物的养分积累功能
养分积累是周丛生物调节稻田养分循环的方式之一。周丛生物中TN 和TP 的浓度分别为0.8至12.5 g/kg 和0.3至6.3 g/kg(图 3A)。周丛生物中TN(r = 0.372,p < 0.001,图 3B)和 TP(r = 0.272,p <0.001,图 3C)的浓度与 EPS 含量显着相关,这可能部分地解释了为什么周丛生物可以积累大量的N和P。
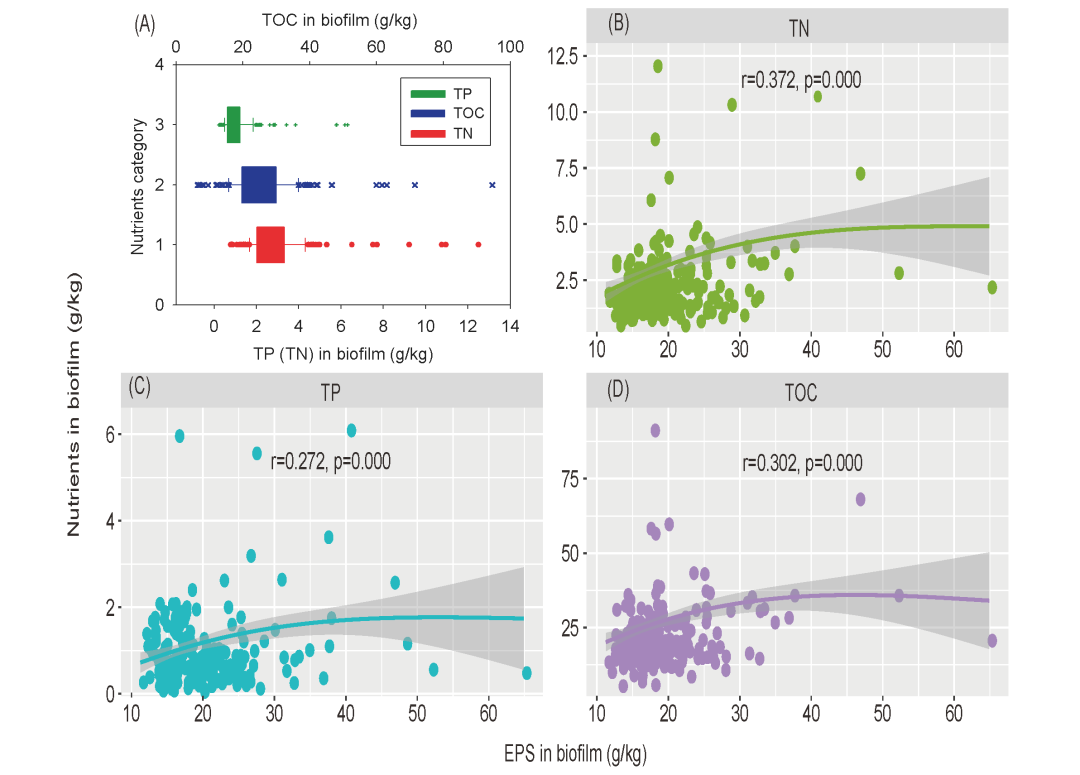
图 3. (A)周丛生物中TN、TP和TOC的含量;(B)周丛生物中EPS与TN含量之间的关系;(C)周丛生物中EPS与TP含量之间的关系;(D)周丛生物中EPS与TOC含量之间的关系。EPS:胞外聚合物;TN,总氮;TOC,总有机碳;TP,总磷。
此外,周丛生物中含有丰富的TOC,周丛生物中的 TOC 量从6.4到94.6 g/kg不等(图 3A中的蓝色条)。周丛生物中的EPS成分与TOC 呈正相关(r = 0.302,p < 0.001,图 3D)。结果表明,EPS含量越高,周丛生物中的TOC越多。因此, EPS在塑造水稻周丛生物养分积累功能方面具有重要潜势。
讨 论
以前,即使是关于稻田周丛生物EPS成分的最基本的信息也没有系统地研究。因此,我们定量分析了从中国主要稻田中周丛生物中EPS成分的含量和组成。结果定量证实了EPS是周丛生物中重要的非生物成分,并且稻田周丛生物中的EPS在不同的水稻种植省份和自然水生生态系统中的差异很大。蛋白质和多糖一般是EPS的两个主要成分。在一些自然(低营养)环境中(如海洋和大沼泽地),EPS主要由多糖组成;但在稻田富营养环境中生长的周丛生物中,蛋白质是最丰富的成分。结果表明,生境的营养状况是影响生物膜中EPS组成的一个重要因素,这延伸了Durmaz和Sanin的类似观察,他们报告了废水的碳氮比影响活性污泥絮状物中EPS的组成。在功能方面,EPS中的蛋白质和多糖具有不同的功能团,蛋白质成分的功能很大程度上影响着EPS的功能。这可以推测为,稻田中的周丛生物的高蛋白质含量会影响并可能促进其富集N和P的潜力。相比之下,周丛生物中的eDNA主要影响其成膜过程。因此,检验这一假设的研究不仅在科学上有意义,而且还可能有实际应用价值。
微生物是周丛生物EPS成分的主要生产者和消耗者,它们的活动将直接改变周丛生物中EPS的组成和含量。我们发现生长在稻田周丛生物中的微生物群落与生长在自然水生生态系统周丛生物中的不同,后者主要由各种光合作用的藻类主导,生长在稻田中的周丛生物主要由化能异养微生物主导,这可能是由于氮和磷的丰富供应及水稻冠层遮挡光照引起的。
周丛生物中的原核生物可能对周丛生物中的EPS含量产生负面影响,这一点从共线性模式的结果中可以看出(参见图2C)。这是因为尽管一些细菌可以产生EPS,但产生EPS的原核生物只占生物膜中整个原核微生物群的一小部分。此外,由于EPS含有大量的单糖,如麦芽糖、d-木糖、甘露糖和d-果糖,因此是一种微生物生长的良好底物。对于周丛生物中的微生物,自养微生物(如蓝藻)不需要EPS作为碳或能量来源,而占主导地位的异养原核生物(参见图2A,B)则需要消耗EPS来生长。因此,在大多数原核生物消耗EPS而只有少数生产EPS的基础上,原核生物对栖息地生物膜中EPS含量的总体影响可能是负面的。
真核生物对EPS积累显示出积极影响(路径系数 = 0.46,图 2D),这得到共线性模式结果的支持(参见图 2C)。真核生物对EPS的总积极影响包括两部分:弱的直接影响和通过影响原核生物产生的强间接影响,间接影响是两者中最重要的(Table S1)。直接效应较弱的原因可能是只有少数真核微生物可以产生EPS以维持其生长的微环境。观察到强烈间接效应的一个可能原因是一些真核生物对原核生物的捕食行为,例如以细菌为食的线虫,可能控制原核生物的丰度,减少原核微生物对EPS的消耗,进而间接增加EPS在周丛生物中的积累。
研究生物多样性的地理分布格局有助于解决宏观生态学和生物地理学最基础的科学问题之一。在这里,我们采用多元回归分析来评估稻田周丛生物中EPS的地理分布模式。然后,采用偏最小二乘法路径建模来综合数据,并分析驱动周丛生物中EPS地理分布的直接和间接影响因素。气候因素,包括温度和光照,主要是驱动周丛生物中EPS含量的地理分布。理论上,纬度越低,日照时间越长,辐射强度越高,光照强度和持续时间越高,预计EPS的产量越高,这与我们的结果吻合。此外,根据之前的调查结果,有效积温对EPS在周丛生物中的地理分布有显着的负面影响。这是因为EPS在保护周丛生物中的微生物免受不利条件影响方面发挥着重要作用。例如,周丛生物中的微生物会分泌更多的EPS,以帮助它们抵抗低温带来的压力。因此,可能某些气候因素会导致水稻周丛生物合成EPS减少,从而导致不同水稻种植区周丛生物中EPS含量的差异。此外,众所周知,光照和温度等气候因素会影响微生物的生长,从而改变周丛生物中的微生物群落结构。由于原核生物和真核生物在周丛生物中的 EPS 含量中可能表现出不同的作用,因此气候引起的不同周丛生物中原核生物和真核生物结构的差异(参见图 2A、B)) 可能是决定EPS(生物量或含量)在中国的地理分布的另一个重要因素。
尽管有EPS在稻田周丛生物中的定量重要性和上述相关性分析,但仍然缺乏 EPS组分在稻田周丛生物中重要性的确凿证据。积累是周丛生物调节稻田养分/元素循环的一种有效方式。在本研究中,我们量化了C、N和P在周丛生物中的积累潜力,并发现EPS组分在塑造周丛生物富集养分方便扮演着重要的角色。
众所周知,EPS 的高蛋白质含量有助于保护周丛生物中的微生物免受不利生长条件的影响,例如水分胁迫、重金属、农药和杀虫剂等。在本研究中,我们发现了EPS在周丛生物中的两个新作用。其一,EPS 有助于通过周丛生物积累N和P,这是因为EPS具有丰富的功能基团,如羧基、羰基等,为N和P提供了多种结合位点,从而促进了N和P通过周丛生物的积累。其次,蛋白质和多糖是EPS的主要成分,周丛生物中的EPS可能是水稻土TOC的来源,进而有望提高水稻土的肥力。
结 论
EPS是稻田周丛生物的一个重要的非生物成分,蛋白质、多糖和eDNA是其主要成分。原核生物和真核生物可能对稻田周丛生物中的非生物成分有不同的影响;也就是说,原核生物可能对稻田周丛生物中的EPS含量表现出负面的影响,而真核生物可能潜在地产生正面影响。周丛生物中的EPS显示出明显的地理印记。周丛生物的EPS含量随着纬度的增加而减少,而EPS的蛋白质和多糖成分的比例显示出相反的趋势。温度和光照是驱动周丛生物中EPS的地理分布的主要因素。此外,数据表明,除了一些已知功能外,EPS还影响到周丛生物积累营养物质的潜势。
方 法
采样区说明
采样区域为中国不同地理区域的稻田,范围从22°25' N到47°16' N(Fig. S1A)。抽样水田分布在东北、华中和华南地区,占中国典型水稻种植面积的93%以上,移植后7-15天收集所有样品。共选取了20个采样区,每个采样区在半径1公里范围内随机选取10个采样点,每个采样点分别采集周丛生物、田面水和水稻土各一份。因此,从20个采样区收集了200份周丛生物、200 份田面水和 200份水稻土样品。从http://data.cma.cn/site/index.html检索各个采样区的气候数据(日照时数、辐射强度和有效积温)。
样品采集
关于样品采集:使用经过消毒的不锈钢刀从土壤表面轻轻刮下周丛生物(约50 g湿重),为了尽量减少生物膜的土壤污染,我们收集了明显可见的土块,并用流动水冲洗数次,以去除生物膜样品中附着的土壤,直到流出物不再浑浊。将周丛生物中的水排干,然后将样品密封在塑料采样袋中(Fig. S1B)。此外,将100毫升相应的田面水装瓶,并收集100克水稻土(0-20厘米,无周丛生物)。所有样品都在冰上运输到实验室并储存在-20°C直至进一步分析。
样品分析
用改良的碱性提取法提取和定量周丛生物中的EPS,并分别用以牛血清白蛋白为标准的Bradford测定法 (Bio-Rad) 和苯酚-硫酸测定法对蛋白质和多糖成分进行定量,使用显微分光光度计 (北京开奥 K5600) 对EPS中的eDNA含量进行量化。在进一步分析之前,部分周丛生物和土壤样品在烘箱(GZX-9140ME)中在60°C下预处理至恒重。总之,0.5 g(干重)的每个周丛生物或土壤样品和5 ml田面水用HNO3 –H2O2消解在消化炉(JKXZ06-8B)中,随后用于测量总氮(TN)和总磷(TP)含量;TN和TP均使用流量分析仪(FS3700,OI Analytical)进行量化。周丛生物中的总有机碳(TOC)用重铬酸钾法测定。使用pH计(Mettler Toledo FE28)测量每个田面水的pH值。
16S 和 18S rDNA 扩增子测序
对每个采样区采集的10份周丛生物样品,分别取2g生物膜混匀,分成三份进行微生物群落分析。计算原核生物和真核生物相对丰度的平均值,以总结每个采样区域的微生物信息。每个样品中的原核生物和真核生物分别通过HiSeq.2500平台的16S和18S rDNA高通量测序进行分析。DNA提取和纯化、测序、质量控制、序列分析、序列存入国家生物技术信息中心(NCBI)数据库等的方法如前所述微生物序列随后被存入NCBI,登录号为PRJNA854262,以及中国科学院北京基因组研究所/中国国家生物信息中心的国家基因组学数据中心的基因组仓库,登录号为GWHBOSZ00000000。
统计分析
使用“psych”包在R中生成相关矩阵,然后使用软件Gephi 0.9.2(法国)对原核生物、真核生物和周丛生物中EPS含量之间的相互作用网络进行分析和可视化。用回归分析法分析了EPS对周丛生物中营养物质(C、N和P)积累的影响、EPS在周丛生物中含量的潜在地理分布模式及EPS中蛋白质与多糖的比例。在R中使用 “vegan”包对驱动周丛生物中EPS含量地理分布的因素进行了统计学意义分析。采用偏最小二乘法路径建模,结合土壤(TOC、TN和TP)和田面水(pH、TN和TP)的特征、气候因素(日照时间、辐射强度和有效积温)对周丛生物中微生物(包括原核生物和真核生物)的影响,评估后者对周丛生物中EPS含量地理分布的影响。所有的统计程序都用SPSS 16.0(SPSS公司)进行。真核生物和原核生物的丰度用Circos软件(http://circos.ca/)进行可视化,其他数字用SigmaPlot 10.0软件(Systat软件公司)生成。
引文格式:
Pengfei Sun, Yingyao Liu, Rui Sun, Yonghong Wu, Jan Dolfing. 2022. “Geographic imprint and ecological functions of the abiotic component of periphytic biofilms.” iMeta. e60. https://doi.org/10.1002/imt2.60
作者简介

孙朋飞(第一作者)
● 中国科学院南京土壤研究所副研究员,硕士研究生导师
● 主要从稻田周丛生物与养分循环的研究。发表论文20余篇。主持国家面上基金、青年基金项目、江苏省青年基金、国家重点研发计划子课题等。担任第十四届中国土壤学会青年工作委员会委员兼秘书。曾获得江苏省科协青年人才托举工程项目资助,受邀担任了Science of the Total Environment、Pedosphere以及Soil Science Society of America Journal等期刊客座编辑

吴永红(通讯作者)
● 中国科学院南京土壤研究所研究员(二级),博士生导师,国家杰青、国家优青、中青年科技创新领军人才
● 自2005年起,在中国科学院南京土壤研究所工作,长期从事土壤生态学研究,服务于农业面源污染防控,耕地质量与生态提升,以及农业绿色发展。主要包括以土-水界面为研究对象,从“土壤-微生物-上覆水”三相界面角度,系统研究了元素在三相界面之间的生物地球化学循环过程与驱动机制,构建了农业面源污染控制与耕地环境提升的协同技术原理,丰富了表生生物地球化学循环理论,为农业绿色发展提供了新思路、新途径。出版中、英文专著各1部。发表论文100余篇,大部分发表在SCI一、二区期刊上。获授权发明专利12件,其中5件发明专利和1件实用新型专利已成功转让(或许可)于商业公司
更多推荐
(▼ 点击跳转)
高引文章 ▸▸▸▸
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
▸▸▸▸
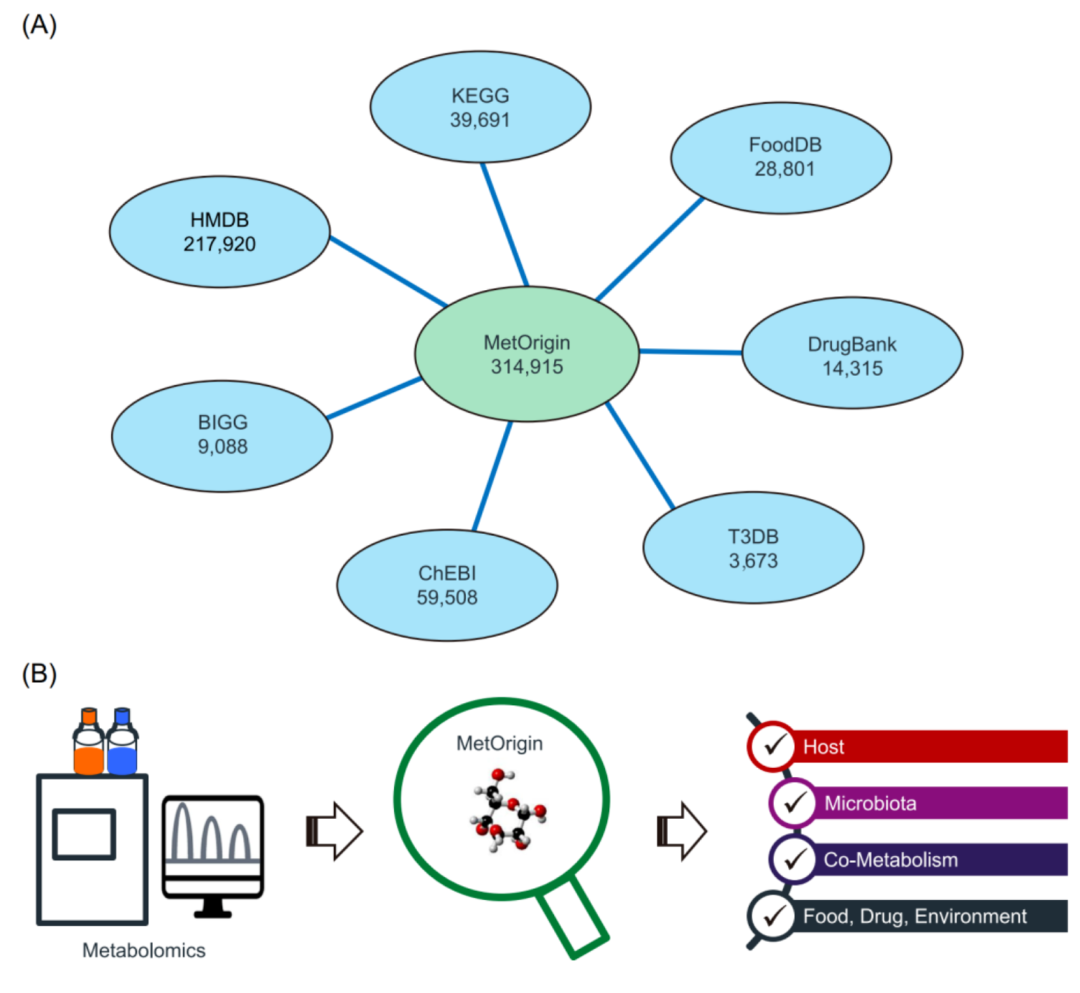
iMeta | 浙大倪艳组MetOrigin实现代谢物溯源和肠道微生物组与代谢组整合分析
▸▸▸▸
iMeta | 高颜值绘图网站imageGP+视频教程合集

第1卷第1期

第1卷第2期

第1卷第3期

第1卷第4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science




