摘要
弥漫大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤亚型,是一种侵袭性淋巴瘤。虽然近年来一线的化疗方案R-CHOP(利妥昔单抗、环磷酰胺、多柔比星、长春新碱和强的松)改善DLBCL患者的预后,但是仍有相当一部分的DLBCL患者因化疗耐药而出现进展或复发,这是困扰临床治疗的一大难题和挑战。目前DLBCL患者出现化疗耐药和复发的机制仍然不清楚,值得我们进一步研究。已有研究发现利妥昔单抗耐药与间充质干细胞相关,本研究将阐明DLBCL患者化疗耐药和复发间充质干细胞的关系,阐明其具体的机制,为临床进一步解决DLBCL患者化疗耐药单核复发提供新的靶向治疗的策略。
这篇文章主要采用CCK-8检测细胞株(SU-DHL-2和SU-DHL-4)的增殖,克隆形成实验检测DLBCL细胞克隆形成能力,用异种移植小鼠来验证DLBCL在体内的生长。分别用免疫组化、RT-PCR和ELISE法检测白细胞介素(IL-6)和IL-17A在DLBCL细胞株共培养液或者肿瘤组织中的表达。用流式细胞术来分析Th17和Treg细胞的表达。使用蛋白印迹法、基因芯片分析和生物信息学分析IL-6和IL-17A介导的DLBCL生长的信号通路。以上的分析均采用SPSS进行统计分析。
研究结果表明:
- 人骨髓来源间充质干细胞(hBMSCs)在体外促进DLBCL细胞的生长,人外周血单个核细胞(PBMCs)会增强这种作用。hBMSCs显著增加了SU-DHL-2和SU-DHL-4细胞的增殖和克隆形成能力;PBMCs显著增加hBMSCs促进SU-DHL-2和SU-DHL-4细胞增殖和克隆形成能力的作用
- hBMSCs分泌IL-6到上清液中,人DLBCL肿瘤组织中IL-6水平高于良性组织。
- hBMSCs在体内分泌通过分泌IL-6促进DLBCL生长。小鼠的实验中,MSC组合IL-6组的肿瘤体积明显大于对照组;MSC组合IL-6组的IL-6 mRNA合蛋白质的水平明显高于对照组
- hBMSCs诱导PBMCs分化为Th17和Treg细胞,从而增加共培养上清液中IL-17A和转录生长因子β的水平。hBMSCs显著增加了PBMCs中Th17和Treg细胞的比例,上调PBMCs中RORγt、FOXP3、IL17A和TGF-β mRNA的相对表达,增加共培养上清液中IL-17A和TGF-β蛋白的水平;包含BMSCs的共培养上清液中IL-6水平均显著升高
- hBMSCs或IL-6促进DLBCL细胞生长是通过保护其免受自发或药物诱导的凋亡,而IL-17A则强化了这些作用。hBMSCs和外源性IL-6和IL-17A促进SU-DHL-4细胞的增殖,而aIL-6和aIL-17A则消除了这些作用;hBMSCs、IL-6或IL-17A降低了自发或利妥昔单抗诱导的SU-DHL-4细胞的凋亡,而aIL-6和aIL-17A则消除了这些作用。
- IL-6或hBMSCs上调p-JAK2和p-STAT3激活JAK2/STAT3信号通路促进DLBCL细胞的生长。IL-6显著促进SU-DHL-2和SU-DHL-4细胞中p-JAK2和p-STAT3,而aIL-6则消除了这些作用;同样,同样,hBMSCs上调了SU-DHL-4细胞中的p-JAK2和p-STAT3,而aIL-6消除了这些作用。
- IL-17A上调细胞周期蛋白D2激活PI3K/Akt信号通路促进DLBCL细胞的生长。
综上,hBMSCs有“双重作用”,即分别通过直接分泌IL-6和间接提高IL-17A水平来促进DLBCL细胞的生长。
前言
- 介绍DLBCL:非霍奇金淋巴瘤是起源于淋巴结或其他淋巴组织的恶性肿瘤,近十几年来其发病率不断升高。弥漫大B细胞淋巴瘤是其中最常见的亚型,约占30%-40%,全世界范围内一年发病率超过10万例,是一种侵袭性淋巴瘤。根据不同的免疫表型,DLBCL分为两种预后不同的基因亚型,分别是生发中心型(GCB型)和非生发中心型(non-GCB),其中Non-GCB型比GCB型预后差。虽然近些年以来的一线化疗方案(R-CHOP)改善了DLBCL患者的预后,但是仍然有相当一部分患者因化疗耐药而出现进展或复发。有研究报道30%的DLBCL病例对利妥昔单抗或利妥昔单抗为基础的化疗方案耐药,60%的以前对利妥昔单抗敏感的淋巴瘤病人再次接受治疗时出现利妥昔单抗耐药,这是困扰临床治疗的一大难题及挑战。
- 介绍利妥昔单抗耐药可能的机制:利妥昔单抗诱发细胞死亡的方式主要有:抗体依赖的细胞介导的细胞毒作用、补体依赖性细胞毒性反应和直接凋亡信号。利妥昔单抗耐药可能与肿瘤内在原因(如CD20表达缺失)或肿瘤微环境有关。有研究发现骨髓来源的间充质干细胞降低B细胞慢性淋巴细胞白血病(CLL)肿瘤细胞表面CD20的表达,从而引起对利妥昔单抗的耐药,另外有研究发现PTEN/PI3K/Akt信号通路参加DLBCL的发展,同时可能参与利妥昔单抗耐药的机制。但目前DLBCL患者出现化疗(包括利妥昔单抗)耐药和复发的机制仍不明确,值得我们进一步研究。
- 以前的观点认为许多肿瘤对化疗药耐药主要是由于肿瘤细胞的基因、表观遗传学或免疫表型突变引起的,但是现在越来越多的证据表明除了肿瘤本身的因素以外,肿瘤微环境的其他细胞,如间充质干细胞(MSCs)、免疫细胞(T、B和树突状细胞)等对于调节肿瘤细胞的生长和存活至关重要。这些细胞通过分泌细胞因子、趋化因子和其他分子来影响肿瘤的生长、发展和转移。MSCs是近年来医学和生物学邻域最引人注目的热点之一,是一群异质性成纤维细胞样祖细胞,具有较强的自我更新和增殖、分化潜能。它可以从多种不同的组织中分离获得,骨髓间充质干细胞(BMSCs)来源最丰富,且目前研究最广泛。MSCs具有向炎性部位定向趋化的特性,之前有研究发现MSCs可以定向趋化并募集到受损的部位。恶性肿瘤实际上是一种永不愈合的损伤,而实际性肿瘤的微环境与受损组织的微环境极为相似,都含有大量的炎性细胞、炎性因子。研究表明,MSCs在T细胞淋巴瘤小鼠肿瘤模型中均具有向恶性肿瘤趋化的特性。越来越多的证据表明MSCs在肿瘤微环境中扮演“帮凶”角色。起促进肿瘤细胞生长、转移,引起化疗或放疗的耐药。在NHL中,多项研究证实了MSCs具有促进NHL生长,抑制NHL细胞凋亡以及引起化疗耐药的作用。Xu L等人通过体外实验以及小鼠模型发现低氧促进人脂肪来源MSCs分泌IL-10激活JAK/STAT3信号通路从而促进伯基特淋巴瘤细胞生长,抑制细胞凋亡,增强肿瘤细胞“干性”和引起化疗耐药。另外多项研究均证明BMSCs激活BAFF/NF-κB通路从而抑制NHL细胞(包括DLBCL和MCL)凋亡,促进化疗耐药产生,其中Lwin T等共培养BMSCs和NHL细胞长达7个月,BMSCs持续作用于肿瘤细胞。Marquez ME等人证实了BMSCs降低B细胞CLL中肿瘤细胞表面CD20的表达,从而引起对利妥昔单抗的耐药,有利用肿瘤细胞的生长。但是,与之相反,也有其他研究均表明不同来源的MSCs对不同病理类型的NHL起抑制作用。
- IL-6的研究进展
- Th17和Treg细胞的研究进展:naive CD4+ T cells在TGF-β和IL-6的共同作用下,经过STAT3通路活化ROR γ t分化为Th17细胞,Th17细胞分泌IL-17和IL-21等多种细胞因子,具有较强的促炎证炎症的作用。初始CD4+ T cells在单独TGF-β的作用下活化Foxp3而分化Treg细胞,Treg细胞分泌IL-10、IL-4和TGF-β,对效应T细胞具有抑制作用。
- 作者基于以上的研究背景,进行假设,①hBMSCs可能通过直接分泌IL-6促进DLBCL细胞生长、抑制凋亡并引起化疗耐药,可能作用的通路为IL-6/JAK2/STAT3或PI3K/Akt。②hBMSCs通过促进外周血单个核细胞(PBMCs)中Th17、Treg细胞的分化,间接上调肿瘤微环境中IL-17A水平,进一步协同DLBCL生长、抑制凋亡并引起化疗耐药。但具体的信号通路仍然需要进一步探索。在本研究中,我们通过体外共培养、CCK-8和克隆形成实验等技术探讨hBMSCs(加/不加PBMCs)在体外对DLBCL细胞株生长的影响;通过ELISA、免疫组化、流式细胞术、qPCR等技术探讨和、hBMSCs在体外DLBCL细胞株共培养体系或患者DLBCL组织中是否分泌或影响IL-6、IL-17及其他相关的细胞因子、Th17细胞/Treg细胞水平;通过CCK-8和PI/Annexin V凋亡检测等技术在体外验证IL-6和IL-17协同抑制DLBCL细胞株或化疗药引起的细胞凋亡;通过基于芯片分析和生物信息学分析、WB和qPCR等技术探索IL-6和IL-17A促进DLBCL细胞株生长的具体信号通路;最后,构建SU-DHL-4细胞的异种移植小鼠模型,通过瘤体测量、qPCR、WB和免疫组化等技术探索hBMSCs对DLBCL细胞生长的影响及其对肿瘤微环境中IL-6的影响,以阐明DLBCL化疗耐药和复发的机制,为临床进一步解决DLBCL化疗耐药和复发提供新的靶向治疗的策略。
材料和方法
实验试剂与材料

人体样本和细胞株
人体病理组织样本的收集
石蜡包埋的组织
DLBCL肿瘤组织的样本
胃肠DLBCL 反应性增生的淋巴结的样本
人体外周血单个核细胞样本的收集与培养
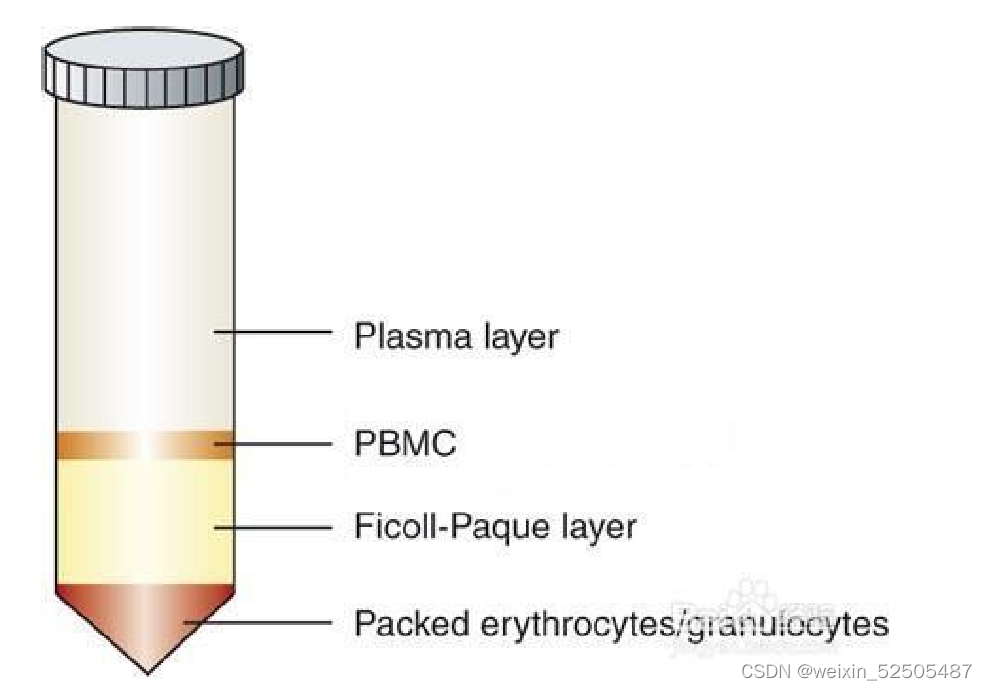
①抽取健康志愿者外周血10ml(注意使用肝素抗凝管),然后用10mlPBS稀释。
②15ml离心管中加入5ml的淋巴细胞分离液,然后将稀释后的血样品平铺到分离液上方,注意动作轻柔,两界面应清晰,三者等比例体积分布
③室温,水平转子700-800g,离心20-30min
④离心结束以后,管底是红细胞,中间层是分离液,最上层是血浆/组织匀浆层,血浆层与分离液层之间是一层致密的白膜,即单个核细胞层。吸取白膜层到15ml的离心管中,然后用PBS稀释以后混匀(白膜层:pbs=1:3),室温下离心(水平转子250g,10min)
⑤弃上清,5mlPBS或细胞清洗液重悬细胞,250g,离心10min
⑥重复步骤⑤
⑦弃上清,细胞重悬备用。
DLBCL细胞株的培养、传代和冻存
①本研究所用的DLBCL细胞株为购买自ATCC(上海,中国)的SU-DHL-2和SU-DHL-4细胞株,它们的培养基为RPMI-1640培养基+10%胎牛血清+1%双抗(Gibco)。具体的复苏、传代、冻存的步骤如下:
②细胞复苏:将冻存细胞从液氮或干冰箱中取出后,在37°水浴锅内不断摇动促进其融化。移入15ml离心管中,加入10ml预热地RPMI-1640完全培养基,轻轻吹打混匀,离心,2000rpm 2min,弃上清,加入10ml RPMI1640完全培养基清洗,弃上清液体,加入10ml RPMI 1640完全培养基,轻轻吹打,接种于10cm盘中,在含有5%CO2的细胞培养箱中培养。
③细胞传代:细胞密度达到80%-90%时候,转移到15ml的离心管,2000rpm 2min,弃上清。再加入10mlPBS悬浮细胞,2000rpm 2min离心,弃上清液。再加入10mlPBS,吹匀,吸取10μl进行计数,按照100万/盘进行接种,在含有5%5%CO2的细胞培养箱中继续培养。
③细胞冻存:当细胞密度达到80%-90%时,转移到15ml离心管,2000rpm 2min,弃上清,加1ml冻存液(90%FBS,10%DMSO),放入冻存盒(内盒有异丙醇,以保证温度降低的速度),立即放入-80°冰箱内,过夜,第二天放入液氮中,可以至少保存两年,如不放入液氮中,可以保存三个月。冻存液的配置:70%完全培养基+20%FBS+10%DMSO,DMSO需要慢慢滴加,边滴加边摇。
体外细胞共培养:作者采用总共四个体外细胞共培养实验,在所有的共培养的实验中,SU-DHL-2/SU-DHL-4细胞和PBMCs的细胞浓度均为1X106个/孔。具体细胞培养的方案如下:
①SU-DHL-2或SU-DHL-4细胞分别单独培养或与hBMSCs以三种不同的比例1:1、1:5和1:0.2共培养72h,培养方式分别为直接培养和间接培养两种方式,间接培养使用Transwell小室(康宁,美国)。培养时间到后收集SU-DH-2或SU-DHL-4细胞进行CCK-8细胞增殖分析,收集上清液进行ELISA检测相关细胞因子水平。
②先按以下分组将SU-DHL-2或SU-DHL-4细胞、PBMCs和hBMSCs按1:1:1的比例在6孔板中共培养,并使用transwell小室。SU-DHL-2单独;SU-DHL-2+hBMSCs;SU-DHL-2+PBMCs+hBMSCs;SU-DHL-4单独;SU-DHL-4+hBMSCs;SU-DHL-4+PBMCs+hBMSCs;其中SU-DHL-2或SU-DHL-4细胞置于小室中,其他细胞置于小室外。所有分组均培养72h,然后收集SU-DHL-2或SU-DHL-4细胞使用CCK-8检测细胞增殖率和使用克隆形成实验检测SU-DHL-2或SU-DHL-4细胞克隆形成能力,收集各组上清液检测相关细胞因子水平。
③先按以下分组将SU-DHL-2或SU-DHL-4细胞、PBMCs和hBMSCs按1:1;1的比例共培养72h,并使用Transwell小室。
PBMSc单独;PBMCs+hBMSCs;PBMCs+SU-DHL-2;PBMCs+SU-DHL-2+hBMSCs;PBMSc+SU-DHL-4;PBMCs+SU-DHL-4+hBMSCs。培养后,收集各组PBMCs用流式细胞术检测Th17和Treg细胞比例,用qPCR检测PBMCs中相关转录因子及细胞因子的水平,另收集各组培养上清液用ELISA法检测各种相关细胞因子水平。
④先按以下分组分为总共11组共培养组:
SU-DHL-4;SU-DHL-4+hBMCs;SU-DHL-4+hBMSCs+aIL-6;SU-DHL-4+IL6;SU-DHL-4+IL-6+aIL-6;SU-DHL-4+IL17;SU-DHL-4+IL17+aIL-17;SU-DHL-4+IL-6+IL-17;SU-DHL-4+IL-6+IL-17+aIL6;SU-DHL-4+IL-6+IL-17+aIL-17;SU-DHL-4+IL-6+IL7+aIL-6+aIL-17。其中细胞因子的浓度为IL-6(0.5ng/ml),aIL-6(50μg/ml),IL-17A(0.1ng/ml)and/or aIL-17A(10μg/ml),SU-DHL-4和hBMSCs的比例为1:1,总共培养72h。rituximab(10μg/ml),doxorubicin(2μM)和Ara-C(2μM)在SU-DHL-2细胞凋亡检测前24h分别加入。然后SU-DHL-2/SU-DHL-4细胞收集后用CCK-8和PI/Annexin V检测其细胞增殖和凋亡。
细胞增殖率和克隆形成实验
SU-DHL-2/SU-DHL-4细胞的增殖率使用CCK-8法检测,克隆形成能力用克隆形成实验检测。
软琼脂克隆形成实验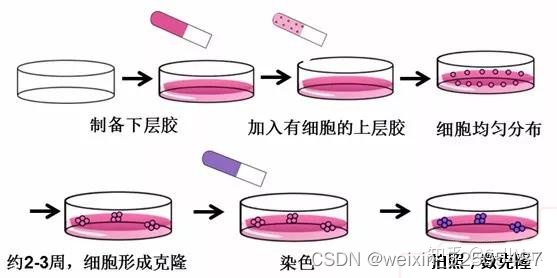
①配制100ml的1.2%Argrose和0.7%Argrose,Argrose用DNA电泳用BIOWEST REGULAR Argrose G10(4°),溶剂用双蒸水,高压灭菌以后,维持在42°中不会凝固。配置500ml 2X1640和0.0005%的结晶紫。
②实验前,将水浴锅放入超净台内,紫外照射,设定稳定为42°。提前融化好血清和双抗。
③如已制好上下胶,则在微波炉中溶解1.2% Argrose下胶和0.7%Argrose上胶,降温以后放入42°水浴锅中保持。。
④根据实验需要的量配置20%FBS+2X1640+2XPS(5种细胞配40ml),每一种细胞设置三个复孔。
⑤铺下胶:按1:1的比例使1.2%Argrose下胶合20%FBS+2X1640+2XPS混合,6孔板每孔迅速加入1.5ml的混合液,轻轻混匀,室温静置待下胶凝固(加混合液时不能产生气泡)。对于一个六孔板,配5ml上诉培养液+5ml 1.2% Argrose下胶于50ml离心管中(离心管一直置于水浴锅内)
⑥细胞计数:取生长期细胞,用0.25%胰蛋白酶消化并轻轻吹打,使之成为单细胞,作活细胞计数,用正常培养液调整细胞密度为40104/ml以上,这样家的体积小于100μl,不会影响其他成分的稀释成都。每孔铺1104/ml,准备四个孔的细胞数,即4104。
⑦铺上胶:按1:1比例混合0.7%Argrose上胶和20%FBS+2X1640+2XPS,每一种细胞需先配置2ml(20%FBS+2X1640+2XPS)+2ml 0.7%Argrose上胶于离心管中混匀,放入42°水浴锅中保持。再将细胞悬液加入上述的混合溶液中,混匀以后迅速加入六孔板中,每孔1ml。待上层琼脂凝固以后,置于5%CO2,37°培养2-3周。
⑧间隔两天补充200μl 10%FBS+1640+1XPS,以防过于干燥。
⑨计数克隆:把平皿放置再倒置显微镜下(100X),在镜下随机选择10个视野,计数视野中大于50个克隆数(>0.05mm的克隆)和所有克隆,克隆形成率=大于50个克隆数\所有克隆数100%。每孔加入1ml的0.005%的结晶紫染色1h以上,镜下拍照。
⑩数据处理:每一个视野是1mm2,六孔板每孔的面积是9.6cm2,则一个孔中总克隆数=平均克隆数*960,如果要比较>0.05mm的克隆的绝对值,则可以利用每孔.0.05mm的克隆数/每孔总克隆数,将分母取一组作为标准,做出此组与其他组的比值系数,再分别用此系数乘以各组>0.05mm克隆数的绝对值,可进行比较。
CCK-8实验
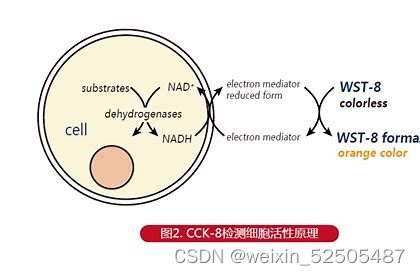
①在96孔板中接种细胞悬液==(100μl/孔)?==。将培养板放在培养箱预培养(37度。5%CO2)。并设置空白组(等量培养液)以及对照组(单纯T淋巴细胞培养)。常规培养过夜。
②向每一孔中加入10μl的CCK-8溶液(注意不要在孔中生成气泡,它们会影响OD值得读数)。
③将培养板在孵箱中孵育4h。
④用酶标仪(Thermo Fisher Scientific,Inc.,Waltham,MA,USA)测定在450nm处吸光度。
⑤计算细胞增殖率,公式为:细胞增殖率=[A(实验组)-A(空白组)]/[A(对照组)-A(空白组)]
免疫组化
本研究中使用免疫组织化学方法(IHC)检测48例人肿瘤组织、18例良性组织和24例小鼠组织中IL-6表达水平。实验步骤如下:
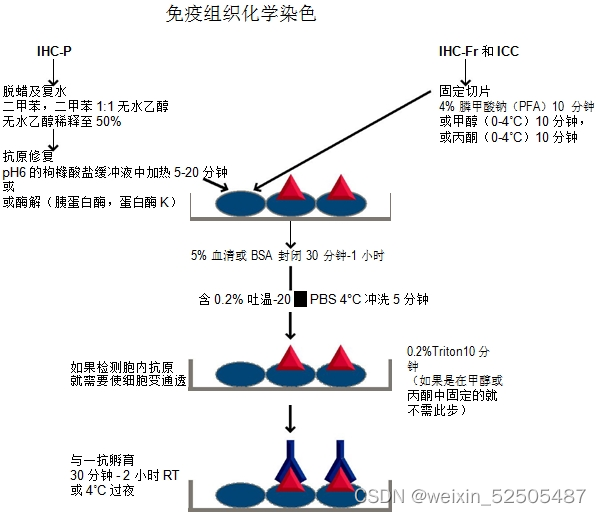
①组织用10%中性甲醛固定,石蜡包埋,石蜡包埋组织被连续切割为4μm的切片,拷片:68°,20min。
②常规二甲苯脱蜡,梯度酒精脱水:二甲苯Ⅰ 20min⇒二甲苯Ⅱ 20min⇒100%酒精10min⇒100%酒精10min⇒95%酒精5min⇒80%酒精5min⇒75%酒精5min
③阻断内源性过氧化物酶:3%H2O2 37°孵育10min,PBS冲洗3X5min
④抗原修复:置于0.01M枸橼酸缓冲液中修复(PH=6.0)中煮沸(95°,15min-20min),自然冷却到室温,再用双蒸水洗。
⑤正常羊血清工作液封闭,37° 10min,倾去勿洗。
⑥滴加一抗4°冰箱孵育过夜,PBS洗3X5min(用PBS缓冲液代替一抗作阴性对照);滴加生物素标记二抗,37°孵育30min,PBS洗3X5min。
⑦滴加辣根过氧化物酶标记的链霉素卵白素工作也,37°孵育30min,PBS洗3X5min。
⑧DAB显色,自来水终止,苏木素复染,常规脱水,透明,干燥,封片。
⑨用相对积分光密度(IOD)定量测量石蜡切片中IL-6的表达,在40X的高倍镜下至少采集三幅不同石蜡切片的图像,有经验丰富的病理学家利用Image Pro Plus 6.0计算石蜡切片的图像IOD和平均IOD。以平均IOD最低的石蜡片作为阴性对照,计算相对IOD的公式为平均IOD/阴性对照。
实时荧光定量PCR
根据制造商的要求,使用TRIZOL试剂从SU-DHL-2细胞,PBMCs细胞或小鼠肿瘤组织中分离出总RNA。根据制造商的要求,使用Primescript RT Master Mix(Takara)将RNA反向逆转到cDNA上。


蛋白印迹分析(Western Blot)
简单的蛋白印迹实验归结如下:使用蛋白酶抑制剂(Roche)的十二烷基硫酸钠缓冲液溶解SU-DHL-2或SU-DHL-4细胞或肿瘤组织。通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离出等量的蛋白质,并转移到聚偏二氟乙烯膜上,在4°下使用特异性的抗体封闭过夜。所用抗体为JAK2,p-JAK2,STAT3,p-Akt,Akt,cyclin D2,P27,IL-6以及GAPDH。然后用辣根过氧化物酶标记的二抗培养膜,用增强化学发光试剂观察蛋白条带。
流式细胞术
本研究采用流式细胞术检测Th17细胞和Treg细胞的比例,简单的实验步骤归结为:首先,将细胞密度调整为2*106个/ml。对于Th17细胞,在37°和5%CO2条件下,在培养基中加入50ng/ml的佛波脂、1μg/ml的离子霉素和10μg/ml的Brefeldin A,刺激细胞5h。然后在室温下用抗CD4-FITC和抗IL-17A-APC抗体对细胞进行1h染色,在室温下,用抗CD4-FITC、抗Foxp3-PE和抗CD25-APC抗体对Treg细胞进行分析,并用Flowjo 10软件对数据进行分析。CD4+IL-17A+细胞被定义为Th17细胞,CD4+CD25+Foxp3+细胞被定义为Treg细胞。
酶联免疫吸附实验
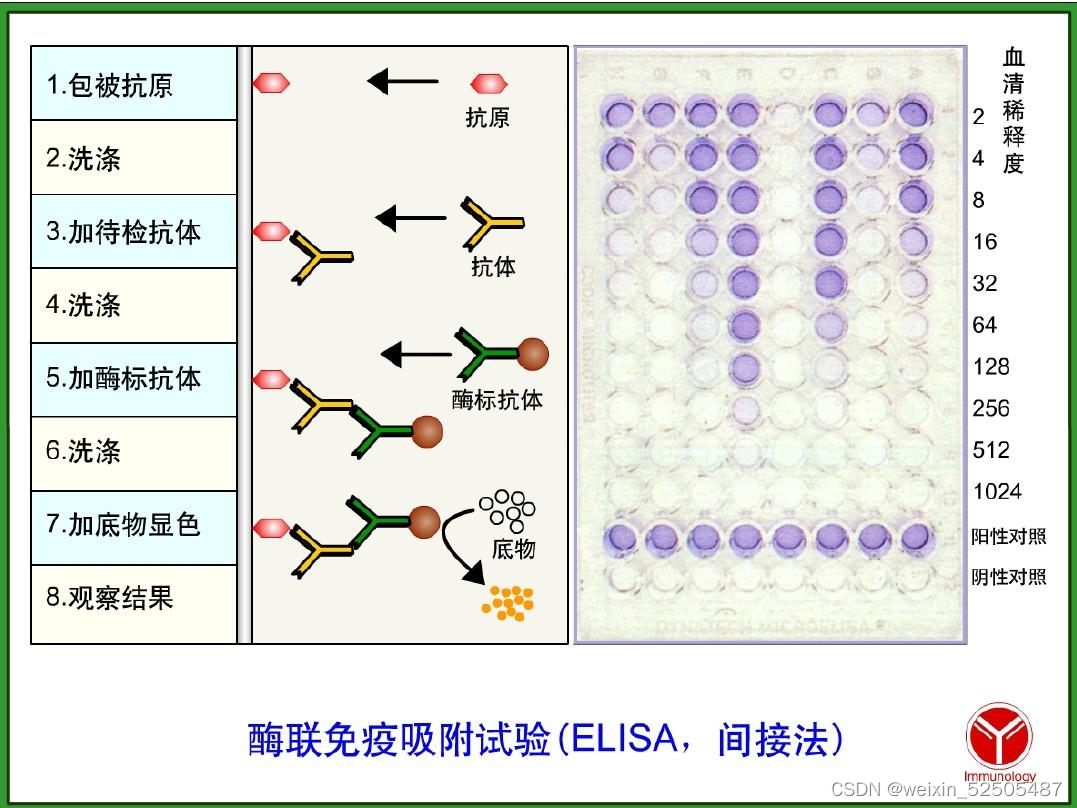
在指定时间收各实验方案中各组培养上清液,然后按照IL-17A、IL-6、IL-10、IL-1β、PGE2和TGF-β的ELISA试剂盒说明书进行测定,用多功能微孔板分析仪测出各血清吸光度(A)值,通过绘制标准曲线计算出各细胞中细胞因子的浓度,评估上清液中的。下面以IL-17A为例说明ELISA的操作步骤。
自备材料
450nm波长的酶标仪
加样枪
自动洗板机
坐标纸
计时器
震荡器
标本的收集和处理:
标本应当清晰并避免溶血。如果允许的话,未知标准应当进行一系列的稀释以确定最佳稀释度类保证测定的质量。
血清:使用血清分离管,允许凝固时间至少为30min,然后离心1000g 10min。分离血清层并立即分析,或者血清标本保存在<-70°,并避免反复冻融。
试剂盒样品的准备
①将20倍浓缩洗液稀释至1X。例如,配1L 1X 洗液,应当在950ml去离子水加入50ml的浓缩液。
②复溶Human IL-17A Standard,按照Human IL-17A Standard小瓶标签的说明,在小瓶里加入一定体积的Assay Buffer A,使之成为20ng/ml的标准原液,轻柔混匀。将复溶的标准原液在室温下放置15min,vortex再次彻底混匀
③一般情况下,分析样本不需要稀释,如果需要稀释的话使用Assay Buffer A。
操作程序
①使用前将所有试剂恢复至室温。强烈建议所有标准及样品应当双份或三份,每一次分析都需要一条标准曲线。
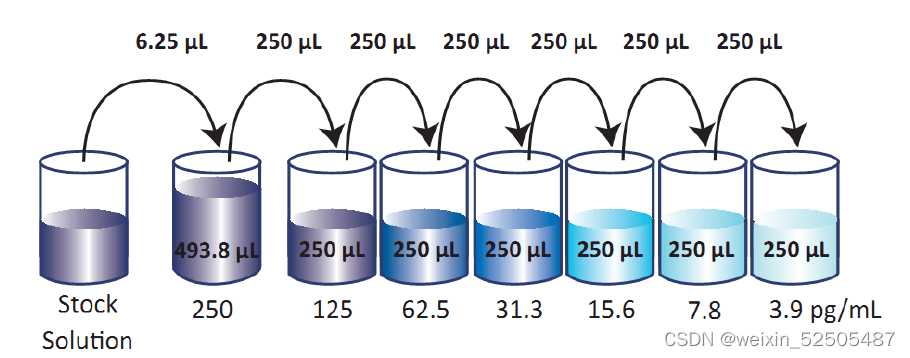
②将6.25μl标准原液加入到493.75μl的Assay Buffer A当中,成为500μl的250pg/ml的top标准,将250pg/ml的top进行六次倍比稀释。分别得到IL-17A的系列标准,250pg/ml、125pg/ml、62.5pg/ml、31.3pg/ml、15.6pg/ml、7.8pg/ml和3.9pg/ml。Assay Buffer A作为0pg/ml。
③洗板:使用至少300μl 1X洗液洗板4次,在吸水纸上尽力拍干。后来每一次的洗板液量都尽量相同。
④加Assay Buffer A:每孔加50μl的Assay Buffer A(标准液和样本均需要)。
⑤加样:每孔加50μl标准液或样品
⑥孵育:用试剂盒提供的密封膜将板密封,在室温下200rpm震荡2h
⑦洗板:弃去孔内容物,洗板4次,同步骤3
⑧加抗体:每孔加100μl的Human Detection Antibody。密封,室温震荡1h。
⑨洗板:弃去内容物,洗板4次,同步骤3
⑩加酶:每孔加100μl Avidin-HRPD。密封,室温震荡30min。
(11)洗板:弃去内容物,洗板5次,同步骤3.对于最后一次洗板,用1X 洗液浸泡每孔30s至1min,这样能减小背景。
(12)显色:每孔加100μl Substrate Solution F,在黑暗中孵育30min。高含量的IL-17A孔会变成蓝色。此步无需密封。
(13)停止反应:每孔加入100μl的stop Solution。蓝色会变成黄色。
(14)读OD值:在30min内用450nm的波长读取OD值,如果能够读570nm,570nm下的吸收率会少于450nm下的吸收率。
细胞凋亡的检测
采用Annexin V/propidium iodide的法检测DLBCL细胞凋亡。将细胞接种于48孔培养板上,用/不用化疗药物培养72h,培养以后用冷的PBS洗涤两次,再悬浮于浓度为1*106细胞/ml的结合缓冲液中,100μl的溶液转移到5ml的试管中,加入5μl Annexin V-FITC和5μl的propidium iodide。试管轻轻的旋转,在室温下在黑暗中国孵育15min。培养结束时,加入300μl的结合缓冲液。立即用流式细胞仪进行流式细胞分析。
人类基因表达谱分析以及生物信息学的分析
SU-DHL-2(2*106细胞/ml)与IL-17A(100pg/ml)共培养72h,后被收集起来。用TRIZOL试剂提取每一个样品的总RNA,测定RNA表达谱,筛选DEGs
异种移植小鼠模型
实验采用雄性裸鼠(BALB/c,20-30g)6-8周龄。在干净的条件下,将小鼠安置在微型的隔离笼中进行检测。所有实验程序和方案均获得广州市第一人民医院动物管理和使用委员会的批准。将SU-DHL-4细胞(1107cells/100μl PBS)皮下接种于裸鼠右侧翼,3mm直径肿瘤发生以后将小鼠随机分为三组(每一组8只)。MSC组(5105细胞/100μl PBS);IL-6组(10μg/kg/次);对照组(100μl/次)。所有组每三天注射一次,总共5次(第0、3、6、9、12).每3天测量一次肿瘤大小,直到注射hBMSCs、IL-6和PBS后28天。肿瘤体积按照以下公式进行计算:肿瘤体积(mm3)=(a2b)/2,其中a代表短轴的长度,b代表长轴的长度。在hBMSCs\IL-6和PBS注射后28天处死小鼠,切除肿瘤并制备IHC,qPCR和WB分析。
统计分析
对于基因芯片分析来说,使用p值阈值和FDR确定DEGs,以及p<0.05和FDR<0.05.所有的分析均采用SPSS 17.0来进行。计量的资料表示平均值±标准差。采用Two-tailed independent-sample Student’s t/t来进行两组之间的比较。单因素方差的分析和Student-Newman-Keuls/Dunnett’s T3检验(每两组之间)用于多组之间的比较。卡方检验用于检验两组之间的计数资料比较,p<0.05被认为是差异有显著。
实验结果
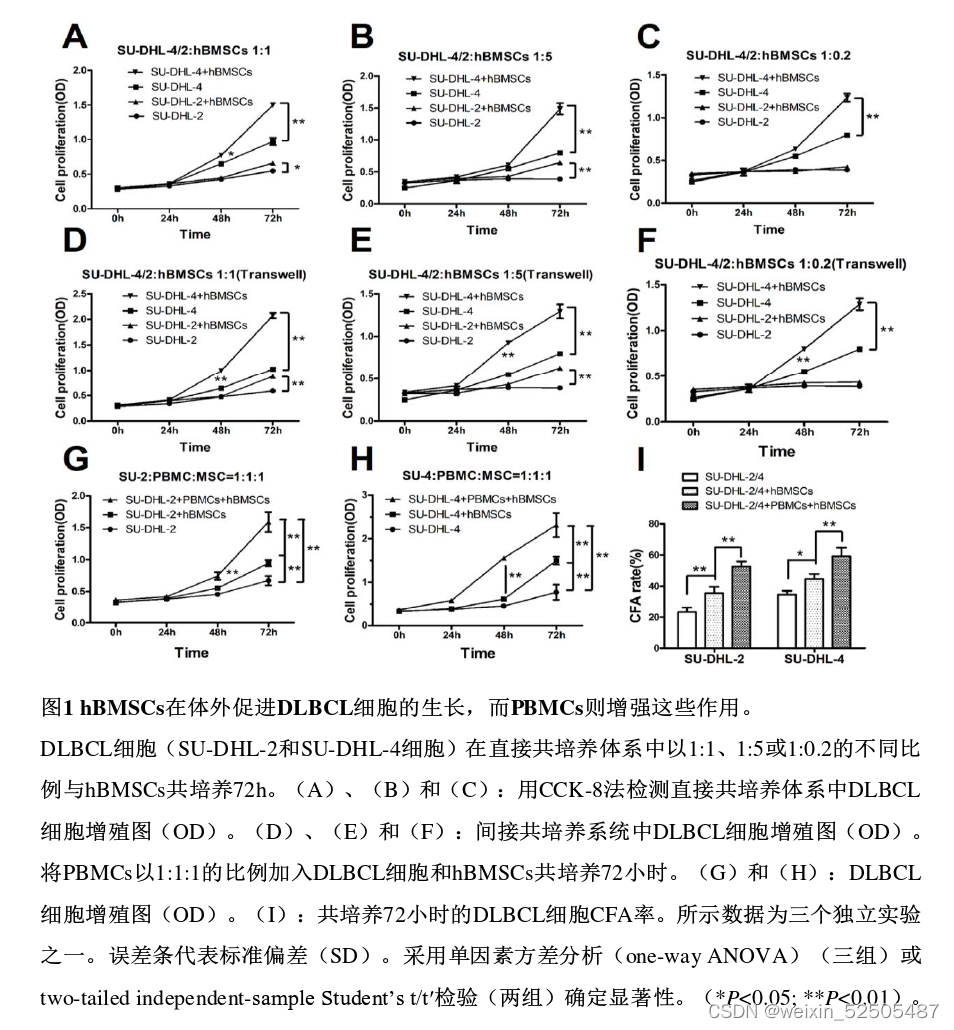
hBMSCs在体外促进DLBCL细胞的生长,而PBMCs则增强这些作用。
为了研究hBMSCs在体外是否促进DLBCL细胞的生长,将hBMSCs与SU-DHL-2或SU-DHL-4细胞以不同比例在直接或间接的体系中共培养72h,然后在不同的时间点用CCK-8检测SU-DHL-2和SU-DHL-4细胞的h BMSCs在直接(图1A-C)或间接(图1D-F)共培养系统中
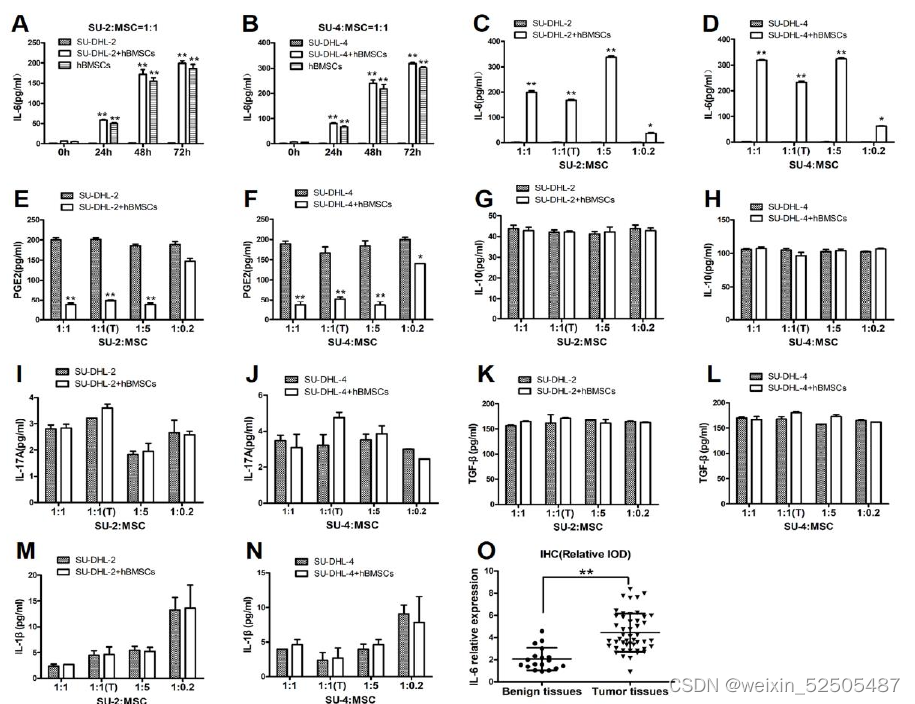
hBMSCs分泌IL-6到共培养的上清液中,人DLBCL肿瘤组织中的IL-6水平高于良性组织。
- hBMSCs通过分泌可溶性细胞因子来促进DLBCL细胞的生长,因此,我们尝试鉴定这些细胞因子。
- 实验结果表明,h BMSCs与SU-DHL-2和SU-DHL-4细胞共培养时,以时间依赖的方式显著地分泌IL-6到共培养上清液中(图2A和B);此外,hBMSCs在直接或间接共培养系统中以不同的比例显著地分泌IL-6(图2C和D)。
- HBMSCs组的PGE2水平在不同比率下降低(图2E和F)
- 两组间的IL-10、IL-17A、TGF-β和IL-1β水平无差异
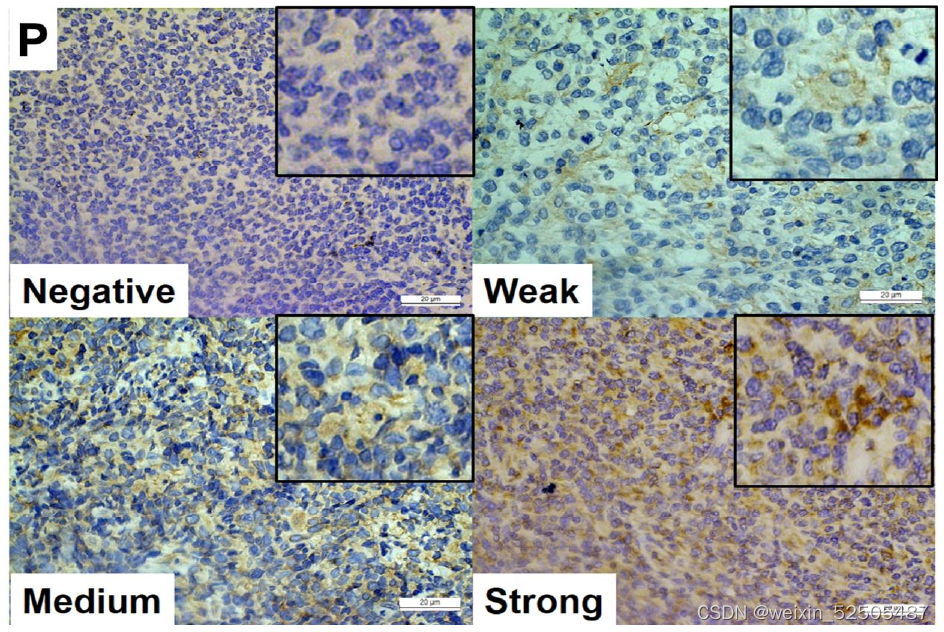
- IHC法分别检测了人肿瘤组织和良性组织中IL-6的相对表达。肿瘤组织中的IL-6水平明显高于良性组织(图2 O和P)

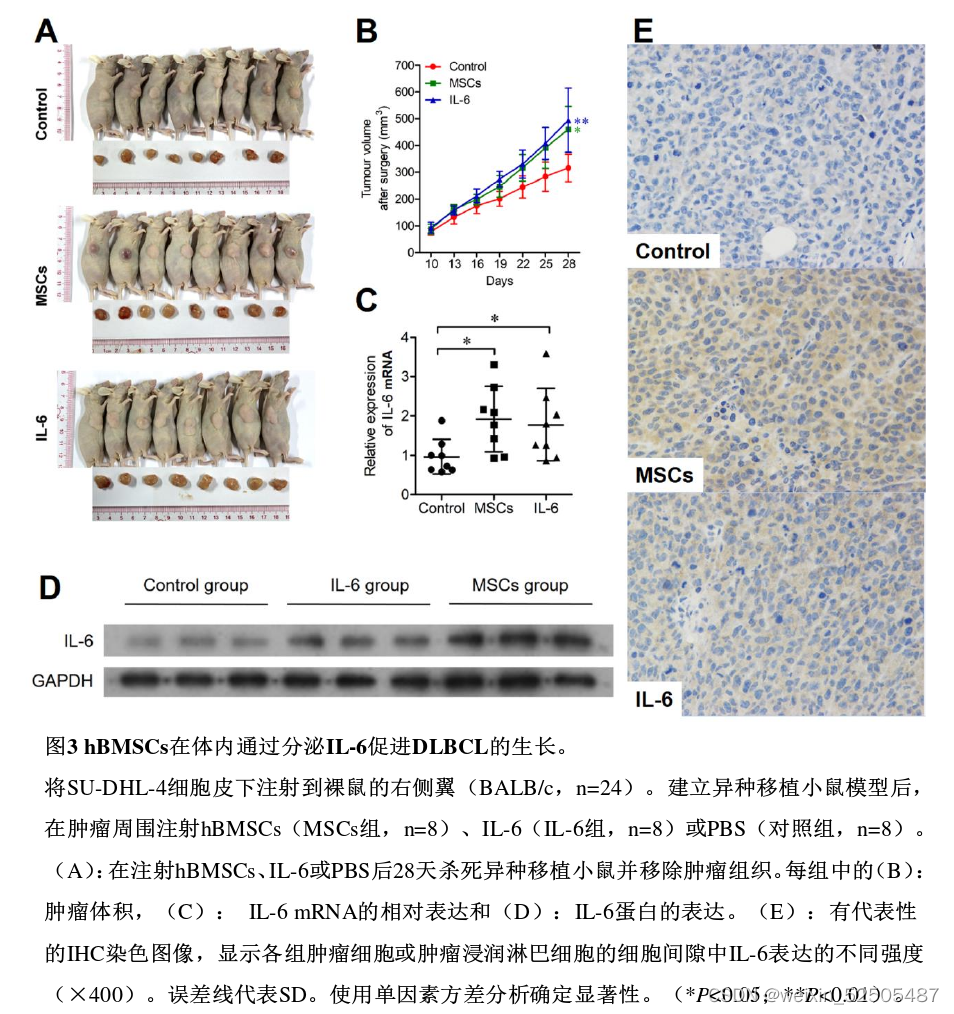
hBMSCs在体内通过分泌IL-6促进DLBCL生长
- DLBCL异种移植BALB/c裸鼠模型
- MSC和IL-6组的肿瘤体积明显大于对照组(图3B)
- MSC组和IL-6组的IL-6 mRNA和蛋白质水平明显高于对照组
- IHC染色发现MSC组和IL-6组肿瘤组织中的IL-6水平高于对照组
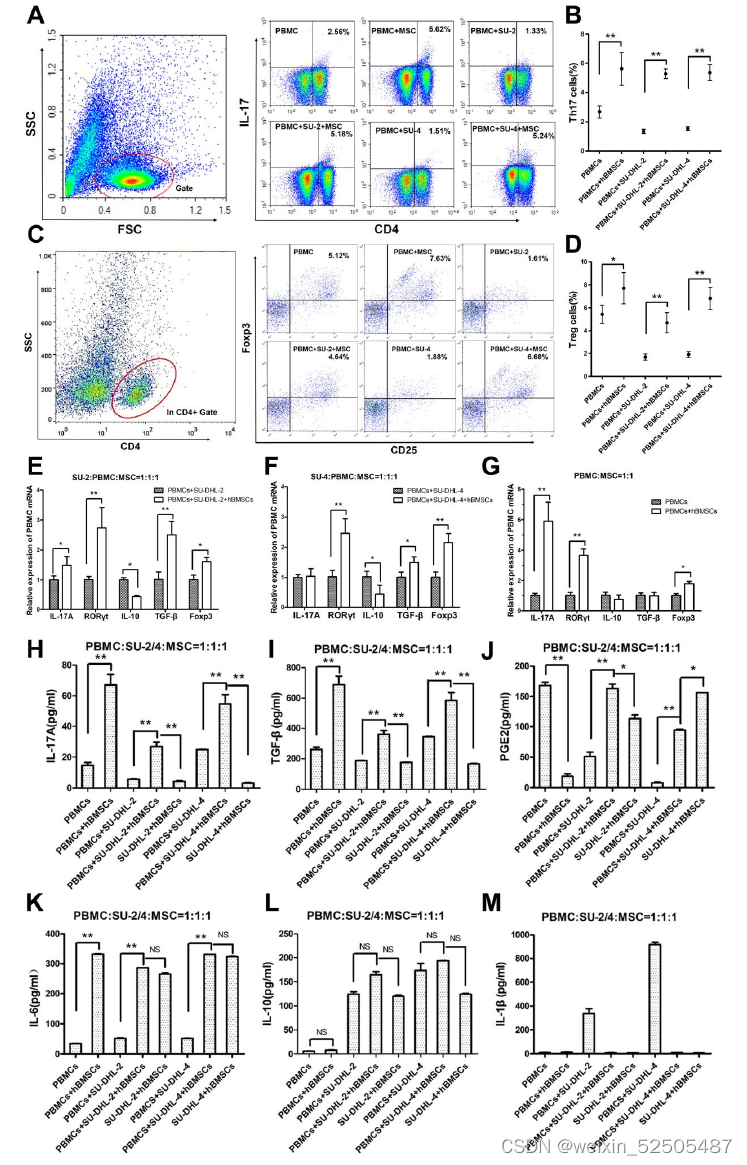
hBMSCs诱导PBMCs分化为Th17和Treg细胞,从而增加上清液中的IL-17A和TGF-β水平。
- 分别用hBMSCs、PBMCs或DLBCL细胞株组成的8组共培养72h
- Transwell小室分离细胞,用FACS和qPCR检测6组共培养中的PBMCs
- 用ELISA检测8组共培养中的上清液
- 在有或无h BMSCs的情况下,三个配对组的比较显示,h BMSCs显著增加了每配对组PBMCs中Th17和Treg细胞
- 在转录水平,当与PBMCs或DLBCL细胞系共培养时,hBMSCs上调了PBMCs中RORγt和Foxp3的相对表达
- hBMSCs上调了PBMCs中的IL-17A和TGF-β的相对表达-转录水平
- hBMSCs增加了共培养上清液中IL-17A和TGF-β蛋白的水平
- hBMSCs组的共培养上清液中IL-6水平均显著升高
- 表明由h BMSCs分泌到上清液中的IL-6诱导PBMCs分化为Th17细胞
- 高TGF-β水平诱导Treg细胞分化

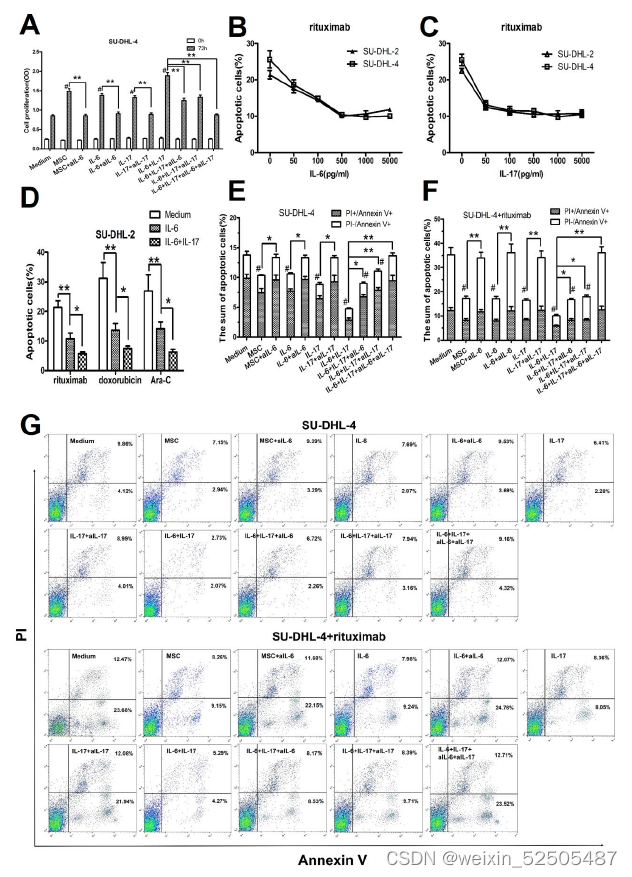
hBMSCs或IL-6促进DLBLC细胞生长是通过保护其免受自发或药物诱导的凋亡,而IL-17A则强化了这些作用。
- IL-6或IL-17A在套细胞淋巴瘤或DLBCL中起着促肿瘤因子的作用
- 假设h BMSCs分泌IL-6到DLBCL的肿瘤微环境中,而IL-6直接促进DLBCL的生长,并且诱导Th17细胞分泌IL-17A,从而增加了这种促进作用。
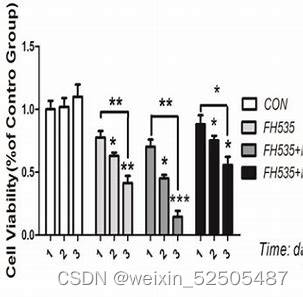
- h BMSCs和外源性IL-6和IL-17A促进了SU-DHL-4细胞的增殖,而aIL-6或aIL-17A则消除了这些作用
- IL-17A增加了IL-6的促进作用,而aIL-6和aIL-17A联合使用则消除了这些作用
- 外源性IL-6和/或IL-17A对DLBCL细胞自发或药物诱导凋亡的影响
- 外源性IL-6或IL-17A以浓度递增方式加入SU-DHL-2或SU-DHL-4细胞中共培养48h,随后在用FACS检测细胞凋亡前使用利妥昔单抗治疗24h
- IL-6或IL-17A以浓度依赖性方式显著地保护SU-DHL-2或SU-DHL-4细胞免受利妥昔
单抗诱导的凋亡。 - 研究了IL-6和IL-17A对SU-DHL-2细胞抗利妥昔单抗、阿霉素和Ara-C诱导的凋亡的保护作用。如图5D所示,IL-6显著降低了三组凋亡细胞的百分比,而IL-17A进一步增强了这些作用。
- 进一步证实IL-6和/或IL-17A对DLBCL细胞凋亡的影响,我们采用IL-6
和/或IL-17A中和抗体阻断IL-6和IL-17A介导的信号传导 - hBMSCs、IL-6或IL-17A降低了自发或利妥昔单抗诱导的SU-DHL-4细胞凋亡,而aIL-6或aIL-17A则消除了这些作用
- IL-17A可以增强IL-6的保护作用,而aIL-6和aIL-17A一起可以消除这些作用

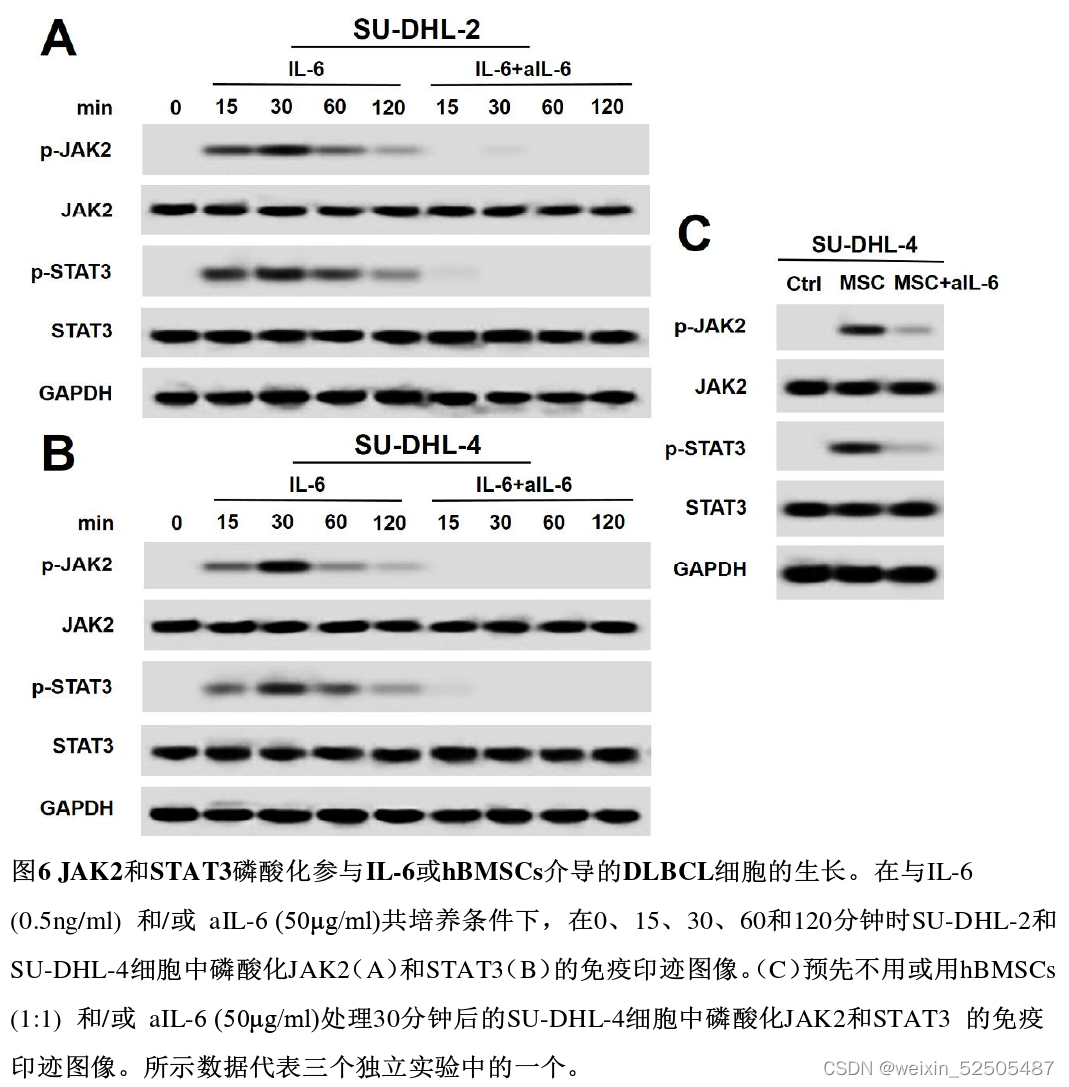
IL-6/hBMSCs上调p-JAK2和p-STAT3激活JAK2/STAT3信号通路促进DLBCL细胞生长。
- 显著促进SU-DHL-2和SU-DHL-4细胞中JAK2和STAT3的磷酸化
- hBMSCs上调了SU-DHL-4细胞中的p-JAK2和p-STAT3
IL-17A上调细胞周期蛋白D2激活PI3K/Akt信号通路促进DLBLC细胞生长
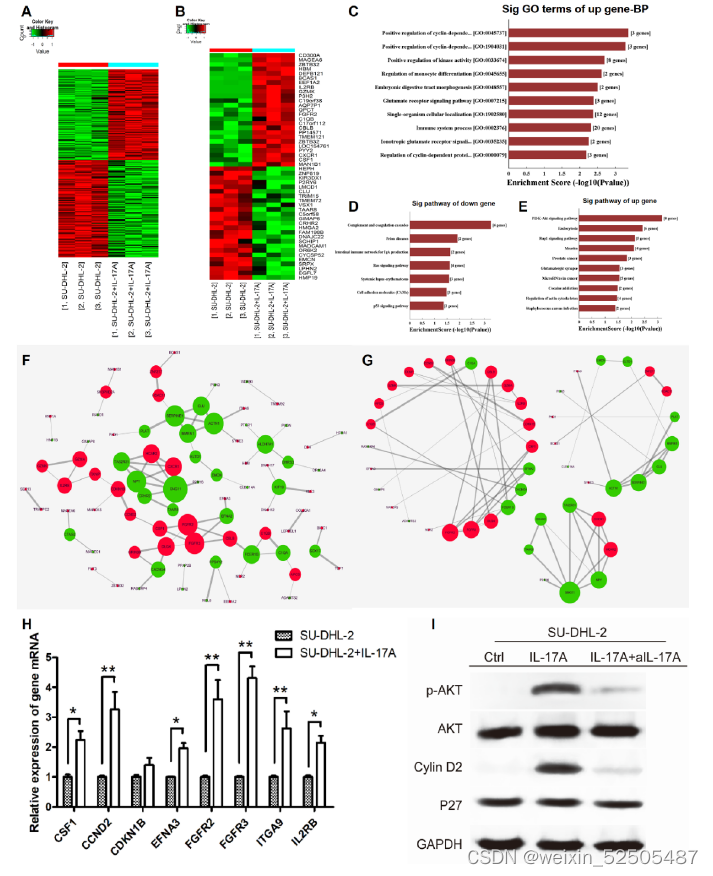
- 进一步研究IL-17A介导的DLBCL细胞生长的分子机制,我们结合qPCR、western blotting和基因芯片、生物信息学分析一起,以评估相关基因和蛋白质的表达
- SU-DHL-2细胞样本与IL-17A共培养72小时,另外三个没有IL-17A的样本作为对照.
- 288个DEGs(139个上调,149个下调)
- 所有上调的DEGs中的前10个最丰富的生物过程GO条款为 positive
regulation of cyclin-dependent protein serine/threonine kinase activity、positive
regulation of cyclin-dependent protein kinase activity、regulation of cyclin-dependent
protein serine/threonine kinase activity - 上述其中三个条款与细胞周期调节有关,参与上调的DEGs分别为PKD1、CDKN1B和CCND2
- 下调的DEGs中的最丰富途径包括Ras信号通路和p53信号通路
- 上调DEGs中的最丰富途径包括PI3K/Akt信号通路、Rap1信号通路、前列腺癌和肿瘤microRNAs
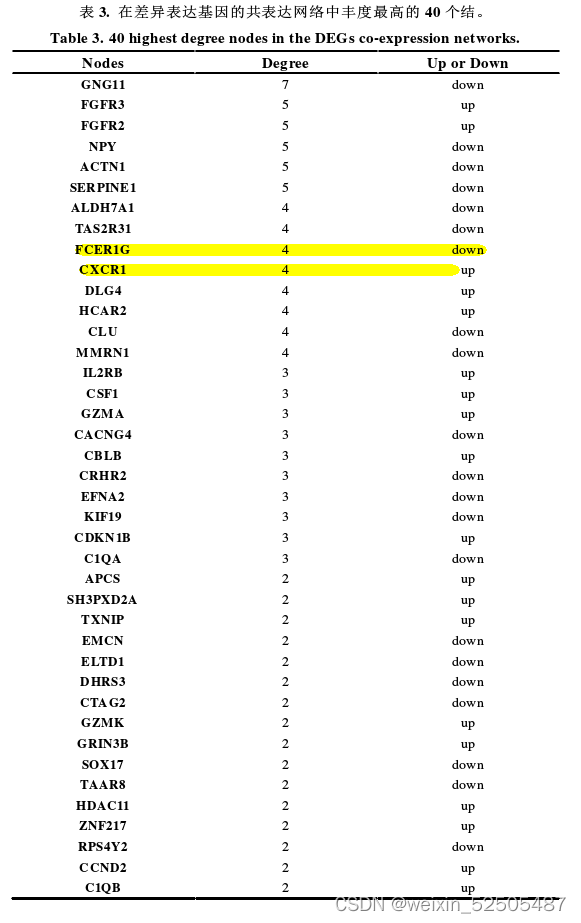
- PI3K/Akt信号通路(8个相关基因:CCND2、CDKN1B、CSF1、EFNA3、FGFR2、FGFR3、IL2RB和ITGA9)在上调的通路中排名第一
- STRING数据库和Cytoscape 3.6.0软件生成所有相互作用的DEGs的共表达网络,以识别可能在IL-17A介导的SU-DHL-2细胞生长中起重要作用的基因
10.qPCR检测8个基因的m RNA表达,用western blotting检测PI3K/Akt通路相关蛋白的表达。与基因芯片结果一致,IL-17A处理的SU-DHL-2细胞的CSF1、CCND2、EFNA3、FGFR2、FGFR3、IL2RB和ITGA9的相对mRNA表达显著较高。IL-17A上调了SU-DHL-2细胞中p-Akt和cyclin D2的表达,而aIL-17A则消除了这些影响 - IL-17A通过激活PI3K/Akt信号,通过上调cyclin D2,促进了SU-DHL-2细胞的生长