今天和大家分享一篇发表于2022年6月的文章,题目为“An innate IL-25-ILC2-MDSC axis creates a cancer-permissive microenvironment for Apc mutation-driven intestinal tumorigenesis”,发表在《Sci Immunol》杂志上。文章主要研究了Interleukin-25 (IL-25) 和第二类固有淋巴细胞 (ILC2s) 在肠道肿瘤发生中的作用。研究发现,肠道IL-25激活的ILC2s创造了一个固有的癌症允许微环境。结肠癌患者具有更高的肿瘤IL25表达,与减少的生存率和增加的IL-25R表达的肿瘤驻留ILC2s以及与受损的抗肿瘤反应相关的髓源性抑制细胞 (MDSCs) 相关。在Apc突变驱动的自发性肠道肿瘤模型中,消除IL-25信号减少了肿瘤,几乎使预期寿命加倍。从机制上讲,IL-25促进了肿瘤内ILC2s,这些ILC2s维持了肿瘤浸润的MDSCs以抑制抗肿瘤免疫。因此,IL-25和IL-33以及ILC2s在癌症中的作用不能被概括。IL-25-ILC2轴在CRC中的原癌性突出了这条途径作为针对CRC的潜在治疗靶点。
1.IL-25 和 ILC2 与人类和小鼠肠道肿瘤发生有关
为了研究 ILC2 激活细胞因子和 ILC2 在肠癌中的潜在作用,作者研究了大型公开数据库(16-18)中的人类 CRC 肿瘤基因表达。根据原发性 CRC 肿瘤 IL25 基因表达将 CRC 患者分为 IL25 高组和 IL25 低组,并比较了他们的预后。肿瘤 IL25 表达高于队列平均值的 IL25 高组患者的 CRC 无病生存率降低(P = 0.0277),而两组患者的肿瘤大小没有差异。
2.IL-25 促进肿瘤 ILC2 浸润和肠道肿瘤发生
为了研究IL-25在肠道肿瘤发生中的作用,用重组IL-25(rIL-25)治疗Apc 1322T/+ 小鼠,每周三次,共8周,结果发现肿瘤负荷大幅增加。这并不是因为肿瘤上皮细胞增殖,因为这些细胞的 Ki67 表达没有差异。相反,rIL-25 治疗显著增加了肿瘤浸润的 ILC2。T H 1和CD8 + T细胞减少了,这两种细胞都是已知的IFN-γ产生者,可以抑制肠道肿瘤(27)。作者发现分析的所有其他免疫细胞类型的频率没有变化,包括 MDSCs、巨噬细胞、传统树突状细胞(cDCs)、浆细胞树突状细胞(pDCs)、肥大细胞、γδ T 细胞、调节性 T 细胞(T regs )和 T H 2 细胞(Gata3 + CD4 + T 细胞)。这些发现表明,在肠道肿瘤中,IL-25优先影响先天性ILC2,而不是适应性T H 2细胞的频率。
3.基因消融 IL-25 可减少小鼠肠道肿瘤并延长寿命
接下来,作者生成了 Il25-番茄报告株(Il25 tom/+ ),并将其与 Apc 1322T/+ 小鼠杂交,以检测番茄荧光蛋白作为肠道肿瘤 Il25 表达的替代物。Il25-番茄表达主要在共表达簇细胞标记物双皮质素样激酶 1(DCLK1)的肿瘤上皮细胞中检测到。这与之前的研究一致,这些研究发现簇细胞是肠道IL-25的主要来源(3),而且在小鼠和人类CRC的Apc突变介导的肠道肿瘤发生过程中,DCLK1 + 簇细胞会增加(28,29)。
4.ILC2s 促进有利于肿瘤生长的微环境
为了确定ILC2频率的增加是否是IL-25依赖性肠道肿瘤发生的原因,作者产生了ILC2缺陷(Rora f/f Il7r Cre/+ )Apc 1322T/+ 小鼠(4)。与 Cre 对照(Rora +/+ Il7r Cre/+ Apc 1322T/+ 或 Rora +/f Il7r Cre/+ Apc 1322T/+ )小鼠相比,ILC2 缺陷小鼠的肿瘤数量和大小大幅减少,预期寿命显著增加(P < 0.0001)。RORα 可能由 CD4 + T 细胞亚群表达,在过敏性炎症过程中有助于皮肤驻留 T regs 的抑制功能(33)。为了解决这个问题,作者培育了 Rora f/f Cd4 Cre/+ Apc 1322T/+ 小鼠。与对照组相比,瘤内 CD4 + T 细胞和 T regs 的频率未受影响,肿瘤数量和平均肿瘤大小也无差异。这些数据共同表明,与IL-25类似,ILC2s也能促进Apc突变介导的肠道肿瘤发生。
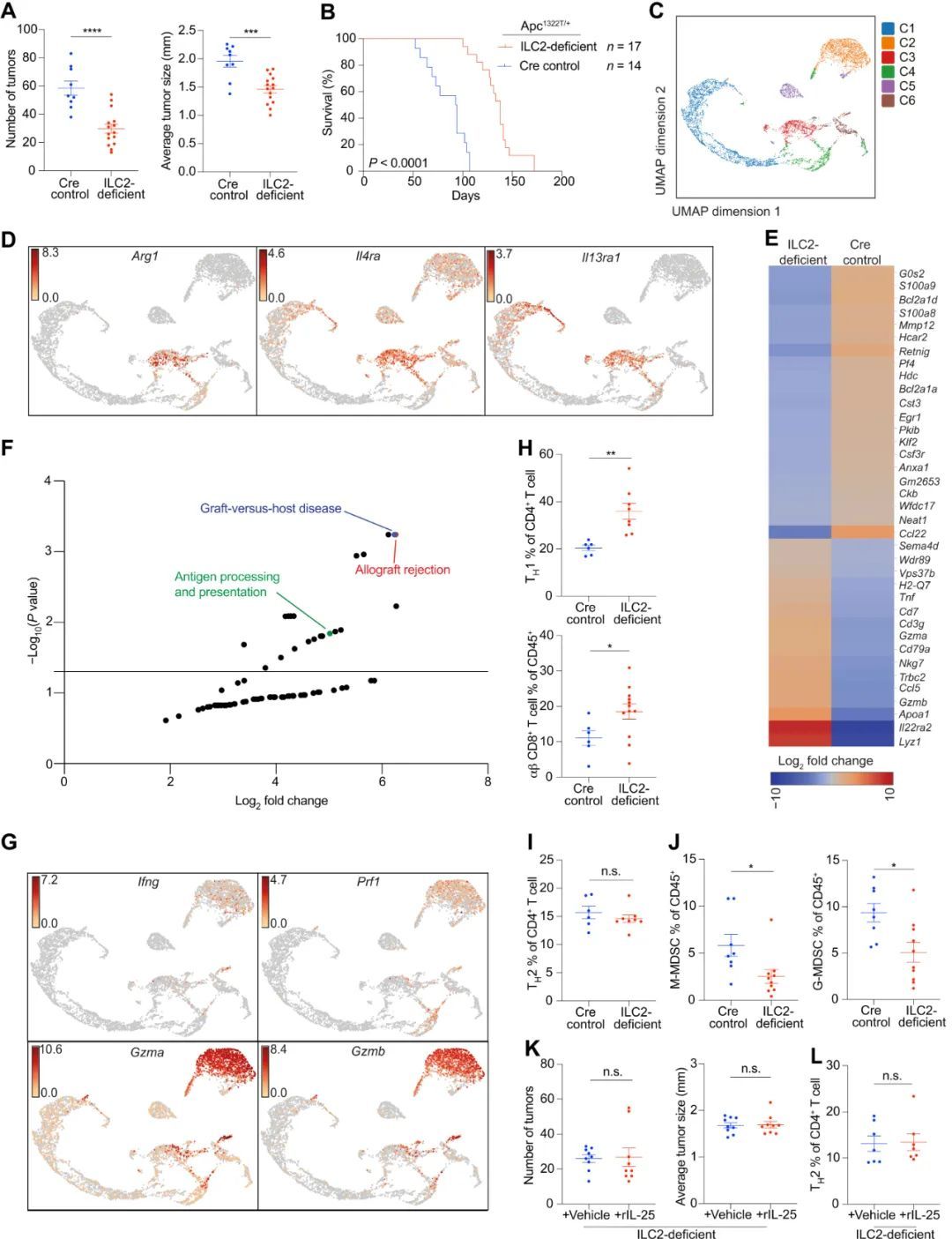
5.ILC2 通过 IL-4 和 IL-13 促进 M-MDSCs 抑制抗肿瘤免疫力
对体内外肠源性肿瘤免疫细胞产生的细胞因子进行分析后发现,肿瘤ILC2表达IL-4,而肿瘤CD4 + T细胞是肿瘤微环境中IL-13的主要来源。这表明了这些细胞因子的先天来源,以及ILC2介导的先天信号在慢性肿瘤环境中的持续作用。接下来,作者测试了 IL-13 消减对体内肠道肿瘤发生的影响。IL-13 缺乏(Il13 tom/tom Apc 1322T/+ )(38) 会减少肿瘤负荷并减少肿瘤 Arg1 + M-MDSCs,同时增加肿瘤浸润 CD4 + 和 CD8 + T 细胞中 IFN-γ 的表达。
6.人类 CRC 的机制途径保护
作者的研究结果表明,先天性 IL-25-ILC2 轴通过促进 MDSCs 和抑制抗肿瘤 T 细胞及 IFN-γ 支持肠道肿瘤的进展。为了在人体中研究这个问题,作者分析了来自新鲜人类 CRC 样本的免疫细胞。T H 1 和 CD8 + T 细胞浸润是人类 CRC 患者在疾病各期生存率的最有力的阳性预后因素之一(39, 40)。相关性分析表明,人类 CRC 中肿瘤 CD8 + T 细胞与 ILC2s 之间以及 T H 1 细胞与 ILC2s 之间存在明显的负相关,这表明 ILC2 频率较高的 CRC 可能会损害抗肿瘤 T 细胞反应并导致预后恶化。
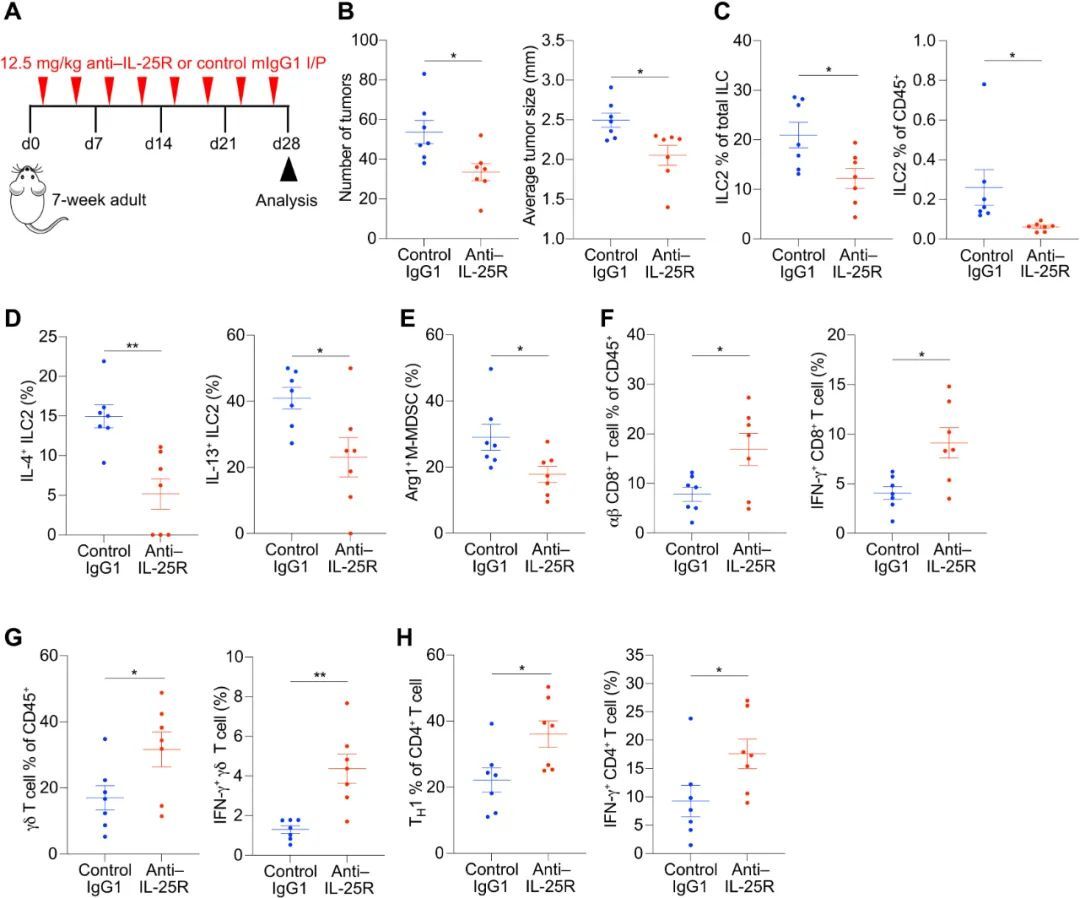
7.治疗性阻断 IL-25-ILC2 轴可促进抗肿瘤免疫并减轻肿瘤负担
在确定了IL-25-ILC2-M-MDSC轴在小肠腺瘤发展过程中的作用后,作者利用一个更接近人类CRC的模型研究了它在结肠浸润性腺癌发展过程中的作用。作者用右旋糖酐硫酸钠(DSS)处理 Apc 突变小鼠,DSS 可诱导出强大的 Apc 突变依赖性浸润性结肠腺癌(41)。Apc 1322T/+ 小鼠在抗IL-25R治疗前喂食DSS诱导结肠腺癌。抗IL-25R治疗有力地减少了结肠肿瘤负荷,并导致肿瘤ILC2、Arg1 + M-MDSCs和G-MDSCs的减少。T H 1细胞和产生IFN-γ的CD4 + 和CD8 + T细胞也增加了,这与抗IL-25R治疗后抗肿瘤免疫力的提高是一致的。
首先,作者深入地探讨了固有免疫和适应性免疫中的ILCs与ILTCs的特性;接着,第二部分详述了它们在癌症免疫监控中的核心角色;在第三部分,作者描述了作为连接适应性免疫和固有免疫之间桥梁的机制;最后,第四部分讨论了基于ILC和ILTC的免疫疗法及其未来的治疗潜力。这篇文章内容丰富,为作者提供了许多生信分析的新视角,对于从事免疫研究的朋友们来说,这是一篇不容错过的好文章!